
| A. | 所得的分散系属于悬浊液 | B. | 所得的分散系中的分散质为Fe2O3 | ||
| C. | 给分散系通电时阳极周围黑色不变 | D. | 该分散系能产生丁达尔效应 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
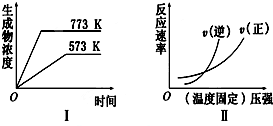
| A. | 2SO3(g)?2SO2(g)+O2(g)△H>0 | B. | N2(g)+3H2(g)?2NH3(g)△H<0 | ||
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | D. | H2(g)+CO(g)?C(s)+H2O(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
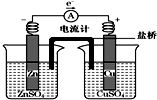
| A. | 盐桥是浸泡过KCl溶液的琼脂形成的,其中Cl-移向左池 | |
| B. | 铜片质量逐渐减少 | |
| C. | 电流从铜片经导线流向锌片 | |
| D. | 铜离子在铜片表面被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
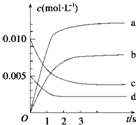 在2L的密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
在2L的密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L氯气所含原子数目为NA | |
| B. | 2 L 0.2 mol/L K2SO4溶液SO42-物质的量浓度为0.4 mol/L | |
| C. | 1 mol Na作还原剂可提供电子数为NA | |
| D. | 同温、同压下NA个CO2分子和NA个O2分子的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
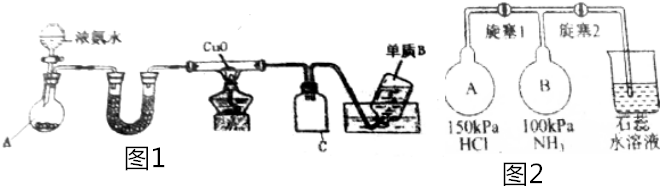
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com