
【题目】请按要求填空:
(1)Mg是第3周期元素,该周期部分元素氟化物的熔点见下表:

①解释表中氟化物熔点差异的原因:
a._____________________________________________________________________。
b.____________________________________________________________________。
②硅在一定条件下可以与Cl2反应生成SiCl4,试判断SiCl4的沸点比CCl4的________(填“高”或“低”),理由________________________________。
(2)下列物质变化,只与范德华力有关的是_________。
a.干冰熔化 b.乙酸汽化 c.石英熔融 d.HCONHCH2CH3溶于水 e.碘溶于四氯化碳
(3)C,N元素形成的新材料具有如下图所示结构,该晶体的化学式为:_____________。

(4)FeCl3常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断FeCl3的晶体类型为_________________。
(5)氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大,熔点高、化学性质稳定。
①氮化硅的硬度________(“大于”或“小于”)氮化碳的硬度,原因是________________。
②下列物质熔化时所克服的微粒间的作用力与氮化硅熔化时所克服的微粒间的作用力相同的是_________。
a.单质I2和晶体硅 b.冰和干冰
c.碳化硅和二氧化硅 d.石墨和氧化镁
③已知氮化硅的晶体结构中,原子间都以单键相连,且氮原子与氮原子不直接相连、硅原子与硅原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式________。
(6)第ⅢA,ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。在GaN晶体中,每个Ga原子与______个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为________。在四大晶体类型中,GaN属于____晶体。
【答案】 NaF与MgF2为离子晶体,SiF4为分子晶体,所以NaF与MgF2远比SiF4熔点要高 因为Mg2+的半径小于Na+的半径,所以MgF2的离子键强度大于NaF的离子键强度,故MaF2的熔点大于NaF 高 SiCl4的相对分子质量比CCl4的大,范德华力大,因此沸点高 ae C3N4 分子晶体 小于 硅原子半径大于碳原子半径,氮碳形成的共价键键长比氮硅键长短,键能更大 c Si3N4 4 正四面体 原子
【解析】(1)①氟化物的熔点与晶体类型有关,离子晶体的熔点较高,分子晶体的熔点较低;
②根据影响分子晶体熔沸点高低的因素分析;
(2)分子晶体中分子之间存在范德华力,范德华力与分子晶体的熔沸点、硬度有关,注意范德华力与氢键、化学键的区别;
(3)根据均摊法判断;
(4)根据分子晶体的熔沸点较低判断;
(5)根据影响原子晶体硬度的因素分析;根据晶体类型分析,熔化时原子晶体破坏共价键,分子晶体破坏分子间作用力;根据最外层电子数和每个原子都满足8电子稳定结构判断;
(6)单晶硅是Si正四面体向空间延伸的立体网状结构,为原子晶体,GaN晶体结构与单晶硅相似,GaN属于原子晶体,根据单质硅的晶体结构判断。
(1)①离子晶体的熔点较高,分子晶体的熔点较低,NaF与MgF2为离子晶体,SiF4为分子晶体,所以NaF与MgF2远比SiF4熔点要高;又因为Mg2+的半径小于Na+的半径,所以MgF2的离子键强度大于NaF的离子键强度,故MaF2的熔点大于NaF;
②由于SiCl4与CCl4形成的晶体均是分子晶体,SiCl4的相对分子质量比CCl4的大,范德华力大,因此沸点高;
(2)a.干冰属于分子晶体,熔化时克服范德华力,a正确;b.乙酸分子间含有氢键,乙酸汽化克服氢键和范德华力,b错误;c.石英的主要成分为二氧化硅,属于原子晶体,石英熔融时克服共价键,c错误;d.HCONHCH2CH3溶于水时克服氢键和范德华力,d错误;e.碘属于分子晶体,溶于四氯化碳只克服范德华力,e正确;答案选ae;
(3)根据晶胞结构可知含有的碳原子个数是8×1/8+4×1/2=3,氮原子全部在晶胞中,含有的氮原子个数是4,则该晶体的化学式为C3N4。
(4)FeCl3常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂,由此判断FeCl3的晶体类型为分子晶体;
(5)①氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大,熔点高、化学性质稳定,这说明二者形成的晶体是原子晶体,由于硅原子半径大于碳原子半径,氮碳形成的共价键键长比氮硅键长短,键能更大,所以氮化硅的硬度小于氮化碳的硬度。
②根据晶体类型分析,熔化时原子晶体破坏共价键,分子晶体破坏分子间作用力,a.单质I2属于分子晶体,克服分子间作用力,晶体硅属于原子晶体克服共价键;b.冰和干冰都是分子晶体,克服分子间作用力;c.碳化硅和二氧化硅都是原子晶体,克服共价键;d.石墨和氧化镁分别是原子晶体、离子晶体,分别克服共价键、离子键,答案选c;
③N最外层电子数为5,要满足8电子稳定结构,需要形成3个共价键,Si最外层电子数为4,要满足8电子稳定结构,需要形成4个共价键,所以氮化硅的化学式为Si3N4;
(6)GaN晶体结构与单晶硅相似,GaN属于原子晶体,每个Ga原子与4个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为正四面体。


科目:高中化学 来源: 题型:
【题目】已知M为红色金属单质、E为用量最大的的金属,X、Y、Z为含有E元素的化合物。根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):

(1)M和热空气以及稀H2SO4反应的离子方程式_____________________________。
(2)实验室中X溶液的保存方法___________________________________。
(3)鉴别Y溶液的阳离子的常见方法_______________________________。
(4)Cl2将Z氧化为K2EO4的化学方程式___________________________________。
(5)某同学取X的溶液,酸化后加入KI、淀粉溶液,充分振荡后溶液变为蓝色。描述出现蓝色可能的原因_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2 L的密闭容器中,发生下列反应:3A(g)+B(g)xC(g)+2D(g),经2 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,以C表示的平均速率v(C)=0.25 mol·L-1·min-1,下列说法正确的是( )
A. 该反应方程式中,x=1 B. 2 min时,A的物质的量为0.75 mol
C. 2 min时,A的转化率为50% D. 反应速率v(B)=0.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 电子云图中的小黑点密表示该核外空间的电子多
B. 电子排布式 1s22s22px2违反了洪特规则
C. 原子序数为7、8、9的三种元素,其第一电离能和电负性均依次增大
D. 元素周期表中Fe处于ds区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中的一部分。

根据A—J在周期表中的位置,用元素符号、化学式或反应式回答下列问题:
(1)氧化性最强的单质是___,用一个化学反应证明H单质的氧化性强于G单质__________。
(2)A分别与F、G、H形成的简单化合物中,稳定性由强到弱的顺序为_________。
(3)B、C、G、H离子半径由大到小的顺序是_________。
(4)D单质可用来制造D—空气燃料电池,该电池通常以氯化钠或氢氧化钾溶液为电解质溶液,通入空气的电极为正极。若以氯化钠为电解质溶液时,正极的反应式为______。若以氢氧化钾溶液为电解质溶液时,电池的总反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如下:

(1)下列有关石墨烯说法正确的是________。
A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12 g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为________。
②乙醇沸点比氯乙烷高,主要原因是_______________________。
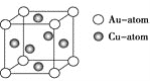
③下图是金与铜形成的金属互化物合金,它的化学式可表示为:________。
④含碳原子且属于非极性分子的是________;
a.甲烷 b.乙炔 c.苯 d.乙醇
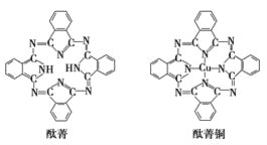
⑤酞菁与酞菁铜染料分子结构如下图,酞菁分子中氮原子采用的杂化方式有:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中,可逆反应m A(g)+n B(g)![]() p C(g)+q D(g),当 m、 n、 p、q 为任意整数时,下列说法一定能说明反应已达到平衡的是( )
p C(g)+q D(g),当 m、 n、 p、q 为任意整数时,下列说法一定能说明反应已达到平衡的是( )
①体系的压强不再改变 ②体系的密度不再改变 ③各组分的浓度不再改变 ④各组分的质量分数不再改变 ⑤反应速率 v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q ⑥单位时间内 m mol A 发生断键反应,同时 p mol C 也发生断键反应
A. ③④⑤⑥ B. ③④⑥ C. ①③④ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有乙酸和乙酸甲酯的混和物中,测得含碳的质量百分数为X,则混和物中氧的质量百分数为( )
A. (1-X)/7 B. 6(1-X)/7 C. (6-7X)/6 D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关细胞中水的叙述,错误的是
A. 细胞内参与物质运输的水是自由水
B. 越冬的动物体内结合水的比例相对较高
C. 同一个体的不同器官的含水量相同
D. 植物蒸腾作用中失去的水主要是自由水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com