
【题目】甲醇是一种可再生能源,又是一种重要的化工原料.具有广阔的开发和应用前景。工业上可用如下方法合成甲醇:CO(g)+2H2(g)![]() CH3OH(g).
CH3OH(g).
(1) 已知:①2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(g)△H=-1275.6kJ·mol-1;
2CO2(g)+4H2O(g)△H=-1275.6kJ·mol-1;
②2CO(g)+O2(g)![]() 2CO2(g)△H=-566.0kJ·mol-1;
2CO2(g)△H=-566.0kJ·mol-1;
③H2O(l)=H2O(g)△H=+44.0kJ·mol-1.
则甲醇液体不完全燃烧生成CO和液态水的热化学方程式为__________。
(2) 在一定温度下,向2L密闭容器中充人1mol CO和2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),5min反应达到平衡,此时CO的转化率为80%。
CH3OH(g),5min反应达到平衡,此时CO的转化率为80%。
①前5min内甲醇的平均反应速率为__________;已知该反应在低温下能自发进行,则反应的△H_______0(填“>”“<”或“=”)。
②在该温度下反应的平衡常数K=__________。
③某时刻向该平衡体系中加人CO、H2、CH3OH各0.2mol后,则v正__________v逆(填“>”“=”或“<”)。
④当反应达到平衡时,__________(填字母)。
a.混合气体的压强不再发生变化 b.反应物不再转化为生成物
c.v正(CO)=2v逆(H2) d.v(H2)=2v(CH3OH)
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(3) "甲醇---过氧化氢燃料电池"的结构主要包括燃料腔、 氧化剂腔和质子交换膜三部分.放电过程中其中一个腔中生成了CO2。
①放电过程中生成H+的反应,发生在__________腔中,该腔中的电极反应式为__________.
②该电池工作过程中,当消耗甲醇4.8g时.电路中通过的电量为__________(法拉第常数F=9.65×104C·mol-1)
【答案】CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-442.8kJ·mol-1 0.08mol·L-1·min-1 < 100 > ad 燃料 CH3OH-6e-+H2O=CO2↑+6H+ 8.685×104C
【解析】
(1)已知:①2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(g) △H=-1275.6kJmol-1,②2CO(g)+O2(g)
2CO2(g)+4H2O(g) △H=-1275.6kJmol-1,②2CO(g)+O2(g)![]() 2CO2(g) △H=-566.0kJmol-1,③H2O(l)=H2O(g) △H=+44.0kJmol-1,则根据盖斯定律可知(①-②-③×4)÷2即得到甲醇不完全燃烧生成CO和液态水的热化学反应方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-442.8kJmol-1,故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-442.8kJmol-1。
2CO2(g) △H=-566.0kJmol-1,③H2O(l)=H2O(g) △H=+44.0kJmol-1,则根据盖斯定律可知(①-②-③×4)÷2即得到甲醇不完全燃烧生成CO和液态水的热化学反应方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-442.8kJmol-1,故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-442.8kJmol-1。
(2)①5分钟反应达平衡,此时CO的转化率为80%,则消耗CO是0.8mol,根据方程式CO(g)+2H2(g)![]() CH3OH(g)可知生成甲醇是0.8mol,浓度是0.4mol/L,因此前5分钟内甲醇的平均反应速率为0.4mol/L÷5min=0.08mol/(Lmin);已知该反应在低温下能自发进行,由于正方应是体积减小的,即△S<0,则根据△G=△H—T·△S可知,该反应为放热反应,即△H<0,故答案为:0.08mol/(Lmin),<。
CH3OH(g)可知生成甲醇是0.8mol,浓度是0.4mol/L,因此前5分钟内甲醇的平均反应速率为0.4mol/L÷5min=0.08mol/(Lmin);已知该反应在低温下能自发进行,由于正方应是体积减小的,即△S<0,则根据△G=△H—T·△S可知,该反应为放热反应,即△H<0,故答案为:0.08mol/(Lmin),<。
②消耗CO是0.8mol,则平衡时氢气和CO的物质的量分别是0.4mol和0.2mol,浓度分别是0.2mol/L和0.1mol/L,化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则在该温度下反应的平衡常数K=0.4/0.22×0.1=100,故答案为:100。
③某时刻向该平衡体系中加入CO、H2、CH3OH各0.2mol后,瞬间CO、氢气和甲醇的浓度分别变为0.2mol/L、0.3mol/L、0.5mol/L,则此时浓度商=0.5/0.32×0.2=27.78<100,因此平衡向正反应方向进行,所以将使ν正>ν逆,故答案为:>。
④a.反应前后气体物质的量减少,故反应达到平衡时,混合气体的压强不再发生变化,故a正确;
b.达到平衡时,反应物和生成物处于动态平衡,故b错误;
c.达到平衡时,2v正(CO)=v逆(H2),故c错误;
d.注意是已知平衡状态让判断选项中说法正确与否,d选项没有注明正、逆,平衡状态时,无论表示的是正反应还是逆反应,这个关系均正确,故d正确。
故答案为:ad。
(3)①燃料腔中的多孔石墨电极为该燃料电池的负极,负极电极方程式为CH3OH-6e-+H2O=CO2↑+6H+,故答案为:燃料,CH3OH-6e-+H2O=CO2↑+6H+。
②4.8g甲醇的物质的量是4.8g÷32g/mol=0.15mol,在反应中失去0.15mol×6=0.9mol电子,所以电路中转移的电量的为9.65×l04C·mol-1×0.9mol=8.685×104C,故答案为:8.685×104C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对于可逆反应:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时,4v正(O2)=5v逆(NO)
B. 若单位时间内生成xmol NO的同时,消耗xmol NH3,则反应达到平衡状态
C. 若有5 mol O===O键断裂,同时有12 mol H—O键形成,此时必为化学平衡状态
D. 化学平衡时,化学反应速率关系是2v正(NH3)=3v逆(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
四 | ⑨ | ⑩ |
(1)写出元素符号:②________,⑦_______。
(2)①的原子结构示意图为_________,⑤的离子结构示意图为________。
(3)元素⑨的最高价氧化物对应的水化物的电子式为________。
(4)元④、⑧、⑩的氢化物的沸点由高到低的顺序为_________(填化学式)。
(5)写出元素③和⑥形成的化合物与元素⑤的最高价氧化物对应的水化物反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、T、X、Y、Z在元素周期表中的相对位置如下图所示,其中Z单质与H2混合遇强光会发生爆炸。则下列判断错误的是
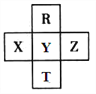
A. 原子半径 Z>Y>R
B. R与Y的电子数相差8
C. 非金属性:Z>Y>X
D. HZO4是目前无机酸中最强的含氧酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)下列物质:①HCl ②NaOH ③Cl2 ④H2O ⑤NH4Cl ⑥MgCl2 ⑦CaO ⑧CO2,其中只存在离子键的是:_________(用序号回答,下同。);既存在离子键又存在共价键的是:_________;试写出⑧的电子式:__________。
(2)在下列物质中,互为同分异构体的是_________(填序号,下同。);互为同素异形体的是_________;互为同系物的是_________;互为同位素的是_________;为同一物质的是_________。
①液氨和氨气 ②NH4CNO和CO(NH2)2 ③4019K和4020Ca ④白磷和红磷 ⑤35Cl和37Cl ⑥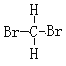 和
和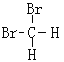 ⑦CH3CH3 和
⑦CH3CH3 和![]() ⑧CH4和 CH2=CH-CH3 ⑨CH2=CH-CH3 和
⑧CH4和 CH2=CH-CH3 ⑨CH2=CH-CH3 和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A. v(B)=0.3 mol·L-1· s-1B. v(A)=0.5mol·L-1· s-1
C. v(C)=0.8 mol·L-1· s-1D. v(D)=30 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若以鸡蛋蛋白液为材料进行蛋白质鉴定实验,发现蛋白液与双缩脲试剂发生反应后会粘固在试管壁上。下列关于这一现象形成原因的描述中正确的是( )
A. 鸡蛋蛋白液稀释不够,搅拌不匀
B. 只添加了双缩脲试剂A,未添加双缩脲试剂B
C. 鸡蛋蛋白液不是合适的实验材料
D. 蛋白液与双缩脲试剂的反应时间不够长
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的溶液中,可以大量共存的离子组是( )
A.Cl-、Na+、AlO2-、MnO4-B.Na+、Cl-、SO42-、K+
C.Al3+、SO42—、Cu2+、NO3-D.K+、Ag+、NO3—、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,能说明HCN是弱电解质的是
A.HCN易溶于水B.NaCN是强电解质
C.NaCN溶液呈碱性D.1 mol HCN与1 mol NaOH恰好完全反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com