
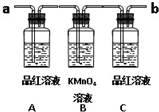
 已知二氧化硫可使高锰酸钾溶液褪色,用如图装置(部分装置没画出)来验证某混合气体中同时含有SO2和CO2.
已知二氧化硫可使高锰酸钾溶液褪色,用如图装置(部分装置没画出)来验证某混合气体中同时含有SO2和CO2.分析 (1)反应产物含有二氧化碳和二氧化硫气体,需要先验证二氧化硫的存在,除去二氧化硫,再验证二氧化碳气体的存在,气体通过溶液时导气管长进短出;
(2)A是验证二氧化硫气体的存在,二氧化硫能使品红溶液褪色;
(3)C瓶是检验SO2是否除尽,防止干扰二氧化碳的检验;
(4)当C装置品红不褪色,澄清石灰水变浑浊说明含有二氧化碳.
解答 解:(1)反应产物含有二氧化碳和二氧化硫气体,都能使澄清石灰水变浑浊,需要先验证二氧化硫的存在,除去二氧化硫,再验证二氧化碳气体的存在,气体通过溶液导气管一个长进短出,所以实验时,反应产生的气体应从a端进入装置;检验二氧化硫并除去二氧化硫后,需要再用澄清石灰水检验二氧化碳,所以在b端再连接一个盛有澄清石灰水的实验装置,
故答案为:a;b;
(2)A是验证二氧化硫气体的存在,二氧化硫能使品红溶液褪色,所以A中的现象是品红溶液褪色,
故答案为:褪色;
(3)C瓶是检验SO2是否除尽,防止干扰二氧化碳的检验,二氧化硫和二氧化碳均能使澄清石灰水变浑浊,所以检验二氧化碳以前应该先除去二氧化硫,
故答案为:检验SO2是否除尽;
(4)当C装置品红不褪色,证明二氧化硫气体除净,后面装置中的澄清石灰水变浑浊证明含有二氧化碳,
故答案为:C中品红不褪色,澄清石灰水变浑浊.
点评 本题考查浓硫酸与碳反应气体产物的检验,题目难度中等.明确实验的原理和方法是解答该题的关键,侧重于酸性氧化物二氧化碳和二氧化硫的性质比较.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
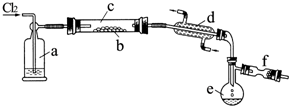 氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃.在空气中强烈发烟,易与水发生水解反应.人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2.如图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去).
氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃.在空气中强烈发烟,易与水发生水解反应.人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2.如图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去).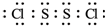 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铬、钒、镨(Pr)、铈(Ce)等金属在工农业生产中有广泛的应用.
铬、钒、镨(Pr)、铈(Ce)等金属在工农业生产中有广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与乙烷体积比为1:4 | B. | 乙烯与丁烷体积比为4:1 | ||
| C. | 丙炔与乙炔物质的量比为4:1 | D. | 乙烯与丁烯物质的量比为1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 一定有乙炔 | D. | 一定有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
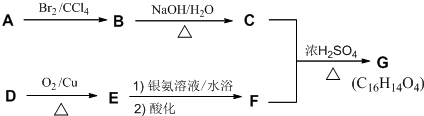
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 反应后溶液pH |
| 甲 | 0.1 | 0.1 | 9 |
| 乙 | c1 | 0.2 | 7 |
| A. | 甲:反应后溶液中 c(Na+)>c(A-)>c(OH-)>c(H+) | |
| B. | 乙:反应后溶液中 c(Na+)=c(HA)+c(A-) | |
| C. | 甲中由水电离产生的c(H+)=1×10-9 mol•L-1 | |
| D. | 乙中c1一定大于0.2 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com