
利用15N可以测定亚硝酸盐对地下水质的污染情况。
(1)下列说法正确的是___。
| A.14N与15N为同种核素 |
| B.14N的第一电离能小于14C |
| C.15NH3与14NH3均能形成分子间氢键 |
| D.CH315NH2与CH3CH214NH2互为同系物 |

(13分)(1)CD(2分,各1分,不全对扣1分)(2) (2分)8(1分)sp3杂化(1分)(3)①Fe-2e-=Fe2+(2分)②H2(2分)强(1分)③0.05(2分)
(2分)8(1分)sp3杂化(1分)(3)①Fe-2e-=Fe2+(2分)②H2(2分)强(1分)③0.05(2分)
解析试题分析:(1) 14N与15N质子数相同、中子数不同,互称为同位素,不是同种核素,A错误;同周期元素从左向右,第一电离能总体趋势增大,但IIA和VA反常,第一电离能:N>C,B错误;N电负性大,NH3分子间存在氢键,C正确;同系物指结构相似,分子组成相差n个CH2,D正确。
(2)N价层电子排布为2s22p3,轨道表示式为 ;CsCl中Cs+和Cl-配位数均为8;15NH4+中N价层电子对数=
;CsCl中Cs+和Cl-配位数均为8;15NH4+中N价层电子对数=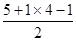 =4,N杂化类型为sp3。
=4,N杂化类型为sp3。
(3)① 阳极为Fe,电极反应式为Fe-2e-=Fe2+。②若硫酸浓度过大,阴极发生2H++2e-=H2↑,阴极产生氢气。说明氢离子浓度越大,氧化性越强。③若电解时转移0.6mol电子,则由Fe-2e-=Fe2+得阳极生成0.3molFe2+,由阳极区化学反应得消耗NaNO20.1mol,所以生成硫酸钠0.05mol。
考点: 核素 第一电离能 氢键 同系物 轨道表示式 CsCl晶胞 中心原子杂化类型 电极反应式 化学计算


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:填空题
已知五种短周期元素的原子序数大小顺序为C>A>B>D>E, A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出E和B形成的化合物分子含非极性共价键的结构式:____________________;
写出A、B、E形成的化合物的电子式:______________。
(2)比较A、B、C三种离子的半径大小_________________(用离子符号表示)。
(3)写出均由A、B、C、E四种元素组成的二种化合物相互反应的离子方程式
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表所列是元素周期表部分短周期的主族元素
| | W | X | Y | |
| R | | | | Z |
 PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X原子的L层电子数是K层电子数的2倍 |
| Y | Y原子的最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的原子核 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示, x越大,其原子吸引电子的能力越强。 下面是某些短周期元素的x值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s) KCl(l)+NaAlSi3O8(s)。
KCl(l)+NaAlSi3O8(s)。
(1)氯化钠的电子式是 。
(2)上述反应涉及的元素中,原子半径最大的是 。
(3)上述反应涉及的位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最价氧化物的水化物均能发生反应,该元素是 。
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量的百分率)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
| 时间(h) 熔出率 温度 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 | 5.0 |
| 800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 | 0.183 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 | 0.687 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 | 0.690 |
| 950℃ | 0.669 | 0.714 | 0.710 | 0.714 | 0.714 | ―― |
 NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,用平衡原理解释该方法可行的原因是 。
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,用平衡原理解释该方法可行的原因是 。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、M、G五种元素分属三个不同短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。Y2是空气的主要成分之一。请回答下列问题:
(1)M在元素周期表中的位置为________________ 。
(2)Y、Z的单质或两元素之间形成的化合物共有________种;Y、G的单质或两元素之间形成的化合物可作水消毒剂的有 (写出两种物质的化学式)
(3)上述五种元素中两元素形成的化合物之间可相互反应生成单质M的化学方程式为
。
(4)ZX与水反应放出气体的化学方程式为___________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
1808年,英国化学家戴维用钾还原氧化镁,最早制得少量的镁。镁是航空工业的重要材料,镁合金用于制造飞机机身、发动机零件等,一架超音速飞机约有5%的镁合金构件,一枚导弹一般消耗100~200公斤镁合金;镁作为一种强还原剂,还用于钛、锆、铍和铀等的生产中;镁是燃烧弹和照明弹不能缺少的组成物;镁粉是节日烟花必需的原料。镁及其合金是一种用途很广泛的金属材料,目前世界上60%的镁是从海水中提取的。从海水(主要含NaCl和MgSO4)中提取金属镁的主要步骤如下:
回答下列问题:
(1)Mg在周期表中的位置______________________,试剂A可以选用_____________________,试剂C可选用_______________________;
(2)步骤①的离子方程式_________________________________________;
(3)用电子式表示氯化镁的形成过程_______________________________;
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为:_____________________________________________________;
(5)戴维制镁的化学方程式为_____________________________________;
(6)配平下列反应的方程式。
① 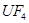 +
+ 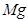 ——
——  +
+ 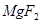
② 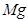 +
+ 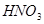 ——
—— 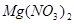 +
+ 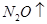 +
+ 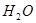
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
四种元素A、B、C、D,其中A元素原子的原子核内只有一个质子;B的基态原子s能级的总电子数比p能级的总电子数多1;C元素的原子最外层电子数是次外层的3倍; D是形成化合物种类最多的元素。
(1)A、D形成的某种化合物甲是一种重要的化工产品,可用作水果和蔬菜的催熟剂,甲分子中σ键和π键数目之比为________;写出由甲制高聚物的反应方程式 。
(2)A、C形成的某种化合物乙分子中含非极性共价键,乙分子属于________(“极性分子”或“非极性分子”);其电子式________;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式 。
(3)写出B的基态原子电子排布图为 。与PH3相比,BA3易液化的主要原因是___________________________________;
(4)笑气(B2C)是一种麻醉剂,有关理论认为B2C与DC2分子具有相似的结构。故B2C的空间构型是________,其为________(填“极性”或“非极性”)分子 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com