
| A、水比硫化氢稳定的原因是水分子间存在氢键 |
| B、升高NH4Cl溶液温度,其水的离子积常数和pH均增大 |
| C、实验中需用0.20 mol?L-1的NaOH溶液950mL,配制时应称取NaOH的质量8.0g |
| D、相同浓度和体积的NaCl溶液与NaHCO3溶液中离子总数NaCl<NaHCO3 |


科目:高中化学 来源: 题型:
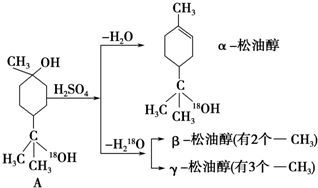
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
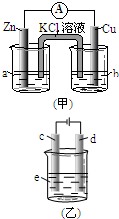 根据右图两个装置回答:
根据右图两个装置回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性:KMnO4<Cl2 |
| B、还原性HCl<MnCl2 |
| C、氧化剂与还原剂的物质的量之比为1:8 |
| D、被氧化的HCl与未被氧化HCl的物质的量之比为5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Si>Na>O |
| B、热稳定性:HF>HCl>H2S |
| C、碱性:CsOH>KOH>NaOH |
| D、失电子能力:K>Na>Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某化验单标有:总胆红素12.3μmol/L,其表示的物理量是物质的量浓度 |
| B、20gNaOH溶于1L水,可配得0.5mol/LNaOH溶液 |
| C、同温同压下,11gCO2气体与32gSO2气体的体积比为1:2 |
| D、100mL0.1mol/L盐酸中含有的氯离子数约为6.02×1021 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作和现象 | 结论 | |
| A | 切开金属钠,钠表面的银白色会逐渐变暗 | Na在空气中会生成Na2O2 |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | SO2通入酸性KMnO4溶液,溶液褪色 | SO2具有漂白性 |
| D | 将充满NO2的试管倒立在水中,试管内液面约上升至试管容积的2/3处;缓慢通入O2,轻轻晃动试管,至液体基本上充满试管 | 从原料的充分利用和减少污染物的排放等方面考虑,该实验对工业生产硝酸有重要启示 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和反应是放热反应,盐类水解反应是吸热反应 |
| B、1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热 |
| C、在101 kPa时,1 mol碳燃烧所放出的热量一定叫碳的燃烧热 |
| D、CO燃烧是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com