
科目:高中化学 来源: 题型:选择题
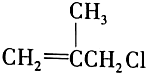 是药品的中间体,属可疑人类致癌物,针对该有机物的描述中,正确的有( )
是药品的中间体,属可疑人类致癌物,针对该有机物的描述中,正确的有( )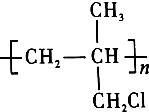
| A. | ①②③④ | B. | ⑤⑥ | C. | ②④⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 电解熔融氧化铝:2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑ | |
| C. | NaHCO3溶液与稀H2SO4反应:HCO3-+H+═H2O+CO2↑ | |
| D. | 向Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中金属共失去电子0.1mol | |
| B. | 合金中,铜的质量为2.8g | |
| C. | 原硝酸的浓度:c(HNO3)=4.5mol•L-1 | |
| D. | 要使溶液中的金属离子完全沉淀,需加5mol•L-1的NaOH溶液60mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2AlCl3(熔融) $\frac{\underline{\;电解\;}}{冰晶}$ 4Al+3Cl2↑ | |
| B. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 | |
| C. | Fe+CuSO4═FeSO4+Cu | |
| D. | 2KCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2K+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消除制硝酸工业尾气中的氮氧化物的污染:NO+NO2+2NaOH═2NaNO2+H2O | |
| B. | 消除硫酸厂尾气中的SO2:SO2+2NH3•H2O═(NH4)2SO3+H2O | |
| C. | 用反应: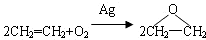 制备环氧乙烷 制备环氧乙烷 | |
| D. | 制CuSO4:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com