
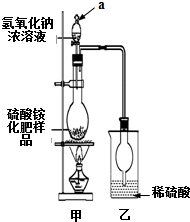
 硫酸铵是一种常用的铵态氮肥.国家规定的质量标准如下:
硫酸铵是一种常用的铵态氮肥.国家规定的质量标准如下:| 指标 项目 | 优等品 | 一等品 | 合格品 |
| 外 观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |
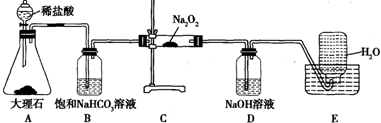
分析 (1)铵根离子与碱反应生成氨气和水,氨气是碱性气体,可以用指示剂检验,氨气与氯化氢气体在空气中能产生白烟,所以也可以用蘸有浓盐酸的玻璃棒;
(2)根据装置图可知仪器名称,烧瓶内硫酸铵与氢氧化钠反应可以生成硫酸钠和氨气、水;
(3)浓氢氧化钠,参加反应的氢氧根离子浓度大,加热能加快反应的速率;
(4)制取氨气为固体和液体反应,所以制取的气体中含有水蒸气,使得吸收的氨气 的质量偏大;
(5)乙增重的质量为生成氨气的质量,根据它算出硫酸铵的质量,再进一步求出样品中硫酸铵的质量,再根据含氮的量进行判断;
解答 解:(1)铵根离子与碱反应生成氨气和水,实验室检验某样品是否为铵盐,是将样品与强碱溶液混合,故选B,氨气是碱性气体,可以用指示剂检验,氨气与氯化氢气体在空气中能产生白烟,所以也可以用蘸有浓盐酸的玻璃棒,故选C或E,
故答案为:B;C或E;
(2)根据装置图可知仪器a的名称是分液漏斗,硫酸铵和氢氧化钠反应生成硫酸钠、水和氨气,反应方程式为:(NH4)2SO4+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2NH3↑+2H2O,离子反应为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:分液漏斗;NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(3)氢氧化钠的浓溶液,电离出的氢氧根离子浓度大,与铵根离子反应的氢氧根离子浓度大,加热温度高,反应速度快,所以,加入足量浓氢氧化钠溶液并充分加热,能使硫酸铵充分反应完全转化为NH3,且全部进入烧杯乙,
故答案为:使硫酸铵充分反应完全转化为NH3,且全部进入烧杯乙;
(4)制取氨气为氢氧化钠溶液与硫酸铵固体反应,所以生成的氨气中含有水蒸气,随氨气一同进入乙装置中,影响氨气的质量,影响含氮量的测定,所以需增加一个干燥装置,
故答案为:甲、乙装置间缺一个干燥装置;
[探究结论]
增重的3.4g为氨气的质最,设13.5g样品中含有(NH4)2SO4的质量为x:
(NH4)2SO4+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2NH3↑+2H2O
132 34
x 3.4g
132:34=x:3.4g 解得:x=13.2g $\frac{13.2g}{132g/mol}$=0.1mol,含0.2mol氮原子,氮的质量为2.8g,氮(N)含量为$\frac{2.8g}{13.5g}$×100%=20.7%,
20.5%≤20.7%≤21.0%,所以是合格品不是一等品,
故答案为:不是.
点评 本题主要考查了实验室制取氨气的实验,掌握反应原理是解答的关键,题目较综合,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
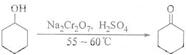
| 物质 | 沸点(℃) | 密度(g-cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 100.0 | 0.9982 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
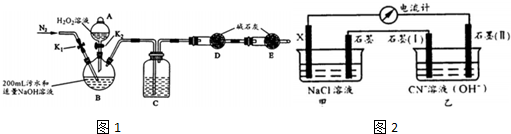
| 步骤1 | 关闭K1,打开K2,滴入足量H2O2溶液,对B加热.充分反应后,停止加热 |
| 步骤2 | 关闭K2,用注射器穿过B装置的胶塞注入 稀H2S04溶液 |
| 步骤3 | 打开K1,通入N2 |
| 实验序号 | 电极(X) | NaCl溶液浓度 (mol/L) | 甲中石墨表面通入气体 | 电流计读数 (A) |
| (1) | Fe | 0.1 | 空气 | I |
| (2) | Al | 0.1 | 空气 | 1.5I |
| (3) | Fe | 0.1 | O2 | 2I |
| (4) | Al | 0.5 | 空气 | 1.6I |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ①②④⑤⑥ | C. | ①④⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在海带灰的滤液中加入几滴稀硫酸,再加入双氧水,即能使淀粉溶液变蓝2I-+H2O2+2H+═I2+2H2O | |
| B. | Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+═SO42-+3S↓+H2O | |
| C. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -═2 Al(OH)3↓+3BaSO4↓ | |
| D. | 在AgCl饱和溶液在加入Na2S:2Ag++S2-═Ag2S↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com