
| Na | Cu | Al | Fe | |
| 熔点 | 97.5℃ | 1083℃ | 660℃ | 1535℃ |
| 沸点 | 883℃ | 2595℃ | 2200℃ | 3000℃ |
| A. | Cu和Na | B. | Fe和Cu | C. | Cu与Al | D. | Al与Na |
科目:高中化学 来源: 题型:多选题
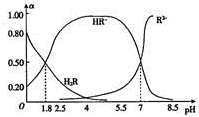 室温时,0.1mol.L-1二元弱酸HzR溶液中H2R、HR-、R2-三种微粒所占物质的量分数(a)随pH的变化趋势如图所示.下列说法不正确的是( )
室温时,0.1mol.L-1二元弱酸HzR溶液中H2R、HR-、R2-三种微粒所占物质的量分数(a)随pH的变化趋势如图所示.下列说法不正确的是( )| A. | H2R的一级电离平衡常数Kal≈0.25 | |
| B. | pH=2.5的H2R溶液中:c(HR-)+2c(R2-)+c(OH-)=l0-2.5 | |
| C. | pH=5.5的该溶液中:c(HR一)>c(R2一)>c(H+)>c(OH一) | |
| D. | 向pH=7的该溶液中滴加少量稀硫酸,a(HR-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
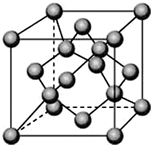 已知A、B、C、D都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他3种元素既不在同一周期又不在同一主族.B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D原子的L层电子数与最外层电子数之比为4:1,其d轨道中有一对成对电子.请回答:
已知A、B、C、D都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他3种元素既不在同一周期又不在同一主族.B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D原子的L层电子数与最外层电子数之比为4:1,其d轨道中有一对成对电子.请回答: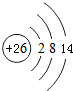 ,它的+3价离子的电子排布式为1s22s22p63s2sp5.
,它的+3价离子的电子排布式为1s22s22p63s2sp5.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
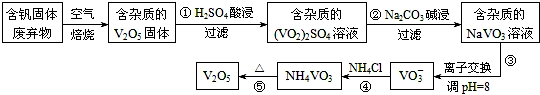
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
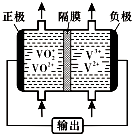
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室里要配制465mL 0.2mol/L的硫酸钠溶液.
实验室里要配制465mL 0.2mol/L的硫酸钠溶液.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
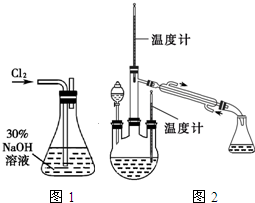 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| B. | 石油裂解、煤的气化、海水制镁等过程中都包含化学变化 | |
| C. | 煤经气化、液化和干馏三个物理变化过程,可变为清洁能源 | |
| D. | 通过化学变化可以实现235U与238U的相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com