
【题目】括号内的杂质能用饱和碳酸钠溶液并借助于分液漏斗除去的是
A. 苯(硝基苯)B. 乙醇(乙醛)
C. 己烯(甲苯)D. 乙酸乙酯(乙酸)
科目:高中化学 来源: 题型:
【题目】氧化亚铁溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述白色沉淀和残渣分别是
A. Fe(OH)3 Fe2O3 B. Fe(OH)2 Fe2O3
C. Fe(OH)2 Fe(OH)3 D. Fe(OH)2 Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组欲从工业废钒催化剂中回收V2O5,通过分析知该废钒催化剂的主要成分如下表:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
他们通过査阅资料找到一种废钒催化剂的回收工艺流程路线如下:

可答下列问题:
(1)“酸浸”时V2O5转化为VO2+,V2O4转成VO2+。则V2O5转化为VO2+ 的离子方程式为______________。 “废渣1”的主要成分是_______。
(2)“氧化”的目的是使VO2+变为VO2+,写出该反应的离子方程式_______________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,则“废渣2”的成分有_____________(用化学式表示)。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROH 为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是___________;为了提高洗脱效率,淋洗液应该呈____________性(填“酸”、“碱”或“中”)。
R4V4O12+4OH-(ROH 为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是___________;为了提高洗脱效率,淋洗液应该呈____________性(填“酸”、“碱”或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出得到沉淀的化学方程式__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物中可能含有:K+、Na+、Clˉ、CO32—、SO42—等离子,将该固体溶解所得到的溶液进行如下实验:
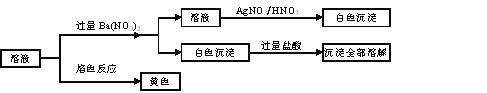
下列说法正确的是
A. 该混合物一定是Na2CO3和NaCl B. 该混合物可能是Na2CO3和KCl
C. 该混合物一定是K2CO3和NaCl D. 该混合物可能是Na2SO4和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如图所示,其中充满NO2的试管是( )。
A. 
B. 
C. 
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示,下列有关说法正确的是
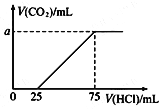
A. 原溶液中NaOH的物质的量为0.75 mol
B. 通入CO2后所得的溶液溶质成分为NaOH和Na2CO3
C. 通入CO2后所得的溶液中含有2.5×10-3 mol NaHCO3
D. 纵坐标中a的数值为224
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TK时,向2.0L恒容密闭容器中充入0.10molCOCl2,发生反应COCl2(g)![]() Cl2(g)+CO(g)经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表,下列说法正确的是:
Cl2(g)+CO(g)经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表,下列说法正确的是:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
下列说法正确的是
A. TK时该反应的化学平衡常数为1/75
B. 反应在前2s的平均速度v(CO)=0.015mol·L-1·s-
C. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.022molL-1,则反应的△H<0
D. 平衡后向上还容器中再充入0.10molCOCl2,平衡正向移动,COCl2的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用丁烷催化脱氢侧备丁烯:C4H10(g)![]() CH4(g)+H2(g)(正反应吸热)。将丁烷和氢气以一定的配比通过填充有催化剂的反应器(氢气的作用是活化催化剂),反应的平衡转化率、产率与温度、投料比有关。下列判断不正确的是
CH4(g)+H2(g)(正反应吸热)。将丁烷和氢气以一定的配比通过填充有催化剂的反应器(氢气的作用是活化催化剂),反应的平衡转化率、产率与温度、投料比有关。下列判断不正确的是
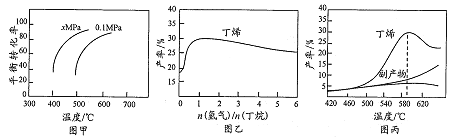
A. 由图甲可知,x小于0.1
B. 由图乙可知,丁烯产率先增大后减小,减小的原因是氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速 率减小
C. 由图丙可知产率在590℃之前随温度升高面增大的原因可能是溫度升高平衡正向移动
D. 由图丙可知,丁烯产率在590℃之后快速降低的主要原因为丁烯高温分解生成副产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com