


科目:高中化学 来源: 题型:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡 常数(25℃) |
1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
| A、等物质的量浓度的各溶液pH关系为pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| B、amol?L-1HCN溶液与amol?L-1NaOH溶液等体积混合后,所得溶液显碱性(pH>7),则c (OH-)>c(H+),c(Na+)>c(CN-) |
| C、冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
| D、NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z、R为前四周期元素且原子序数依次增大.W与Y形成常温下呈液态的化合物G,X可以spm(m=1,2,3)杂化方式与X形成一系列X的化合物,X的单质在高温条件下与G反应生成W单质和气态化合物;W的单质与Z的单质在点燃或光照时均能反应生成1:1的水溶液为常见的酸;R原子的价电子层的未成对电子数为4.回答下列问题:
W、X、Y、Z、R为前四周期元素且原子序数依次增大.W与Y形成常温下呈液态的化合物G,X可以spm(m=1,2,3)杂化方式与X形成一系列X的化合物,X的单质在高温条件下与G反应生成W单质和气态化合物;W的单质与Z的单质在点燃或光照时均能反应生成1:1的水溶液为常见的酸;R原子的价电子层的未成对电子数为4.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
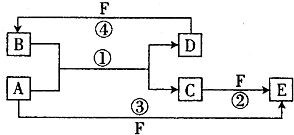
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

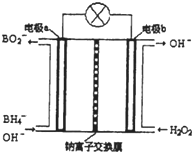
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量 |
| B、厨房中燃气泄漏,立即打开抽油烟机排气 |
| C、硝酸是重要的工业原料,可用于制造炸药 |
| D、高纯硅可用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子序数大小:X>Y |
| B、Xm+和Yn-离子半径大小:Yn-<Xm+ |
| C、在周期表中X、Y在不同周期 |
| D、在周期表中X、Y的族序数之差为:8-(m+n) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解精炼铜时,若转移了NA个电子,则阴极析出32g铜 |
| B、标准状态下,33.6L氟化氢中含有1.5NA个氟化氢分子 |
| C、0.1mol/L的Al2(SO4)3溶液中,Al3+的数目小于0.2NA |
| D、1mol FeCl3跟水反应,完全转化为氢氧化铁胶体后,其中胶体粒子的数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com