
| A. | Ca(HCO3)2(aq)与Ca(OH)2(aq) | B. | Ca(HCO3)2(aq)与NaOH(aq) | ||
| C. | NaHCO3 (aq)与Ca(OH)2(aq) | D. | Mg(HCO3)2(aq)与NaOH (aq) |
分析 A.Ca(HCO3)2(aq)与Ca(OH)2(aq)反应生成碳酸钙、氢氧化钠和水;
B.Ca(HCO3)2溶液与过量NaOH溶液反应,反应生成碳酸钙、碳酸钠和水;
C.清石灰水与过量NaHCO3溶液反应,生成碳酸钙、碳酸钠和水;
D.Mg(HCO3)2(aq)与NaOH (aq)反应不会生成碳酸钙沉淀.
解答 解:A.Ca(HCO3)2(aq)与Ca(OH)2(aq)反应,无论任意比混合,二者反应的离子方程式都为Ca2++HCO3-+OH-=CaCO3↓+H2O,故A正确;
B.Ca(HCO3)2溶液与过量NaOH溶液反应的离子方程式:2HCO3-+20H-+Ca2+═CaCO3↓+2H2O+CO32-,不能用Ca2++HCO3-+OH-=CaCO3↓+H2O表示,故B错误;
C.澄清石灰水与过量NaHCO3溶液反应的离子方程式:2HCO3-+20H-+Ca2+═CaCO3↓+2H2O+CO32-,不能用Ca2++HCO3-+OH-=CaCO3↓+H2O表示,故C错误;
D.Mg(HCO3)2(aq)与NaOH (aq)反应生成碳酸镁或氢氧化镁沉淀,不会生成碳酸钙,故D错误;
故选A.
点评 本题考查离子方程式书写,为高频考点,离子方程式表示一类反应,化学方程式表示一个反应,要根据反应物和生成物特点来分析判断即可,同时考查学生发散思维能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5mol/L 氢硫酸溶液 | B. | 18.4mol/L 盐酸溶液 | ||
| C. | 含甲醛40%的福尔马林溶液 | D. | 含乙酸12%的食醋溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 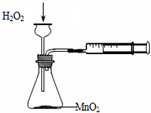 定量测定化学反应速率 | B. | 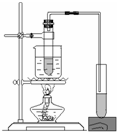 实验室制乙酸丁酯 | ||
| C. | 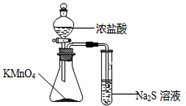 比较KMnO4、Cl2、S的氧化性 | D. | 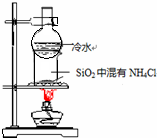 分离SiO2和NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 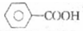 的同分异构体中能发生银镜反应的芳香族化合物有4种 的同分异构体中能发生银镜反应的芳香族化合物有4种 | |
| B. | 纤维素在人体中水解的最终产物是葡萄糖 | |
| C. | 烷烃与聚乙烯结构中均有碳碳单键 | |
| D. | 0.1mol 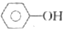 和 和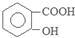 的混合物完全燃烧消耗O215.68L 的混合物完全燃烧消耗O215.68L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
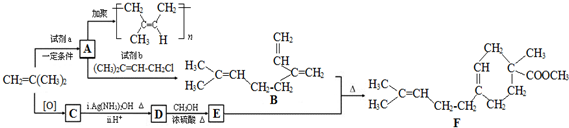
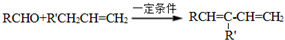
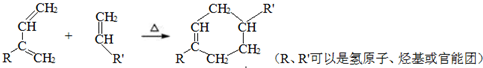
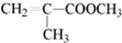 .
.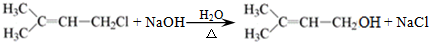 .
.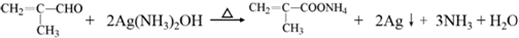 .
.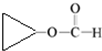 .
.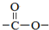 结构.
结构.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
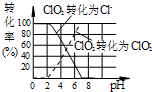 作为世界卫生组织(WHO)推荐的A1级广谱、安全高效消毒剂,二氧化氯(ClO2)在水处
作为世界卫生组织(WHO)推荐的A1级广谱、安全高效消毒剂,二氧化氯(ClO2)在水处
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com