
分析 石墨烯中碳碳间均是碳碳单键,所以1mol的碳能形成2mol的碳碳单键,所以12g石墨烯的物质的量为:$\frac{12g}{12g/mol}$=1mol,所以C(石墨烯,s)+O2(g)=CO2(g),表示断开2mol的碳碳单键和1mol的氧气吸收的能量与形成2mol的碳氧双键放出的热量的代数和,由此分析解答.
解答 解:石墨烯中碳碳间均是碳碳单键,所以1mol的碳能形成2mol的碳碳单键,所以12g石墨烯的物质的量为:$\frac{12g}{12g/mol}$=1mol,所以C(石墨烯,s)+O2(g)=CO2(g),表示断开2mol的碳碳单键和1mol的氧气吸收的能量与形成2mol的碳氧双键放出的热量的代数和,所以理论上每12g石墨烯完全燃烧释放的热量为347.7kJ•mol-1×2mol+497.3kJ•mol-1×1mol-2mol×745kJ•mol-1=-297.3kJ,
故答案为:297.3kJ.
点评 本题考查学生化学反应的能量变化和化学键的键能之间的关系知识,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8g O2的体积为5.6L | |
| B. | 标准状况下,22.4 L H2O所含的分子数为NA | |
| C. | 标准状况下,50mL 0.2mol•L-1的盐酸中含有分子数为0.01NA | |
| D. | 常温常压下,10g氖气含有的原子数为0.5NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | amol | 0 | 0 |
| A. | 当通入Cl2的体积为2.8L时,只有I-与Cl2发生反应 | |
| B. | 当通入Cl2的体积为2.8-5.6L时,只有Br-与Cl2发生反应 | |
| C. | a=0.15 | |
| D. | 原溶液中c(Cl-):c(Br-):c(I-)=10:15:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
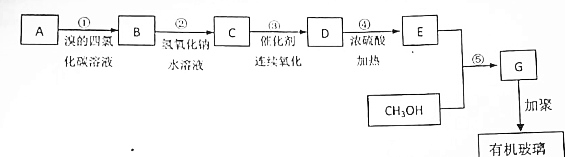
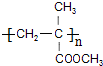 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 20 | 40 | 60 | 80 |
| c(H2O2)/mol•L-1 | 1.0 | 0.60 | 0.40 | 0.20 | 0.10 |
| 现象 | 结论 | |
| 热水中 | 溶液中有气泡产生,比常温快 | 升高温度,H2O2的分解速率加快 |
| 常温中 | 溶液中有气泡产生,且速度较快 | 无 |
| 冷水中 | 溶液中有气泡产生,比常温慢 | 降低温度,H2O2的分解速率减慢 |
| 现象 | 结论 | |
| 丙加入MnO2 | MnO2能加快化学反应速率 | |
| 乙加入FeCl3 | FeCl3能加快化学反应速率 | |
| 甲不加其他试剂 | 溶液中有少量气泡出现 | 不使用催化剂化学反应速率较小 |
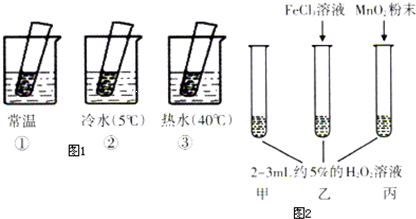
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com