
| X | Y | Z | W | |
| A | C | Fe | NaCl | H2O |
| B | Pt | Cu | CuSO4 | CuSO4溶液 |
| C | C | C | H2SO4 | H2O |
| D | Ag | Fe | AgNO3 | AgNO3晶体 |
| A、A | B、B | C、C | D、D |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
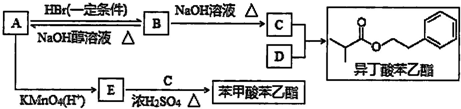
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、可采取在足量空气中充分燃烧的方法消除H2S的污染 |
| B、反应②中的阴极反应式为2H++2e-═H2↑,电解后所得溶液呈酸性 |
| C、如反应①中H2S过量,则反应离子方程式为:2Fe3++3H2S═2FeS↓+S↓+6H+ |
| D、此反应流程图中可循环利用的物质是FeCl3溶液,FeCl3可用作杀菌、消毒剂和净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
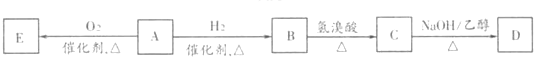
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 |
| 乙醇 | -144 | 78.0 | 0.789 |
| 乙酸 | 16.6 | 118 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0,900 |
| 浓硫酸(98%) | - | 338 | 1.84 |
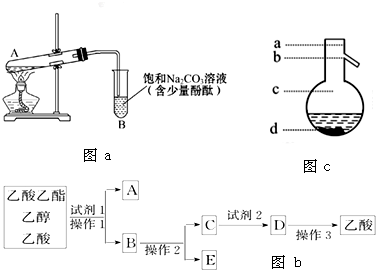
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶解、过滤、蒸发、洗涤 |
| B、溶解、过滤、洗涤、干燥 |
| C、溶解、蒸发、洗涤、过滤 |
| D、溶解、洗涤、过滤、干燥 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com