
| |||||||||||
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:
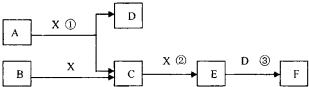
已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液
体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解
质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物之间的转化关
 系如下图:(注意:其中有些反应的条件及部分生成物被略去)
系如下图:(注意:其中有些反应的条件及部分生成物被略去)
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)膦(PH3)是一种无色有剧毒的气体,其还原能力比氨(NH3)强,是一种强还原剂,但膦在水中的溶解度远小于氨,微溶于水。某反应体系中存在下列物质:Cu、H2SO4、CuSO4、PH3、H3PO4、H2O。回答下列问题:ks5u
①上述反应体系中化学反应方程式为__ ;
 ②膦(PH3)在水中的溶解度远小于氨的原因是___ 。
②膦(PH3)在水中的溶解度远小于氨的原因是___ 。
(2)SO2的排放是造成酸雨的主要因素。某地区酸雨 pH随时间的变化如下图所示。请用化学方程式表示该地区酸雨pH随时间增加而减小的原因:
(3)生活污水中含大量细小的悬浮物,可加入某些物质使之聚集成较大的颗粒而沉淀。请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为 。若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
(4)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com