
【题目】某化学兴趣小组用如图装置电解CuSO4溶液,测定铜的相对原子质量. 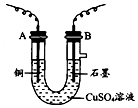
(1)若实验中测定在标准状况下放出的氧气的体积VL,B连接直流电源的(填“正极”或“负极”),并写出B极发生反应的电极反应式 .
(2)电解开始一段时间后,在U形管中可观察到的现象 .
并写出该电解反应总的离子方程式 .
(3)实验中还需测定的数据是(填写序号).
①A极的质量增重mg ②B极的质量增重mg
(4)铜的相对原子质量为:(用含有m、V的计算式表示).
(5)如果用碱性(KOH为电解质)甲烷燃料电池作为电源进行实验,放电时负极的电极反应式为 .
【答案】
(1)正极;4OH﹣﹣4e﹣=O2↑+2H2O
(2)铜电极上有红色固体析出,石墨电极上有无色气体产生,溶液蓝色变浅;2Cu2++2H2O ![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
(3)①
(4)![]()
(5)CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O
【解析】解:(1)若实验中测定在标准状况下放出的氧气的体积VL,说明阳极上是氢氧根离子放电而不是铜放电,所以铜作阴极,石墨作阳极,则A连接直流电源的负极,B连的是正极,是阳极,发生反应:4OH﹣﹣4e﹣=O2↑+2H2O,所以答案是:正极;4OH﹣﹣4e﹣=O2↑+2H2O;(2)电解硫酸铜时,石墨作阳极,则阴极上铜离子得电子而析出铜,阳极上氢氧根离子放电而生成氧气,溶液中铜离子浓度减小,溶液颜色变浅,电池反应式为:2Cu2++2H2O ![]() 2Cu+O2↑+4H+ , 所以答案是:铜电极上有红色固体析出,石墨电极上有无色气体产生,溶液蓝色变浅;2Cu2++2H2O
2Cu+O2↑+4H+ , 所以答案是:铜电极上有红色固体析出,石墨电极上有无色气体产生,溶液蓝色变浅;2Cu2++2H2O ![]() 2Cu+O2↑+4H+;(3)要测定铜的相对原子质量还要测定析出铜的质量,A电极上析出铜,故选①;(4)根据2Cu2++2H2O
2Cu+O2↑+4H+;(3)要测定铜的相对原子质量还要测定析出铜的质量,A电极上析出铜,故选①;(4)根据2Cu2++2H2O ![]() 2Cu+O2↑+4H+知,标况下,生成22.4L氧气析出2mol铜,析出mg铜时放出VL氧气,则铜的相对原子质量=
2Cu+O2↑+4H+知,标况下,生成22.4L氧气析出2mol铜,析出mg铜时放出VL氧气,则铜的相对原子质量= ![]() =
= ![]() ,所以答案是:
,所以答案是: ![]() ;(5)甲烷燃料电池中,负极上甲烷失电子发生氧化反应,电极反应式为:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O,所以答案是:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O.
;(5)甲烷燃料电池中,负极上甲烷失电子发生氧化反应,电极反应式为:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O,所以答案是:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O.


科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X,Y,Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )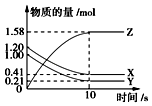
A.反应开始到10 s,用Z表示的反应速率为0.079mol(Ls)﹣1
B.反应开始到10 s,X的物质的量浓度减少了0.79molL﹣1
C.该反应不是可逆反应
D.反应的化学方程式为X(g)+Y(g)Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X,Y,Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )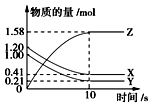
A.反应开始到10 s,用Z表示的反应速率为0.079mol(Ls)﹣1
B.反应开始到10 s,X的物质的量浓度减少了0.79molL﹣1
C.该反应不是可逆反应
D.反应的化学方程式为X(g)+Y(g)Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家开发出一种新型锂﹣氧电池,其能量密度极高,效率达90%以上.电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O ![]() 2I2+4LiOH
2I2+4LiOH
对于该电池的下列说法不正确的是( )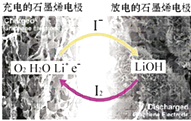
A.放电时负极上I﹣ 被氧化
B.充电时Li+从阳极区移向阴极区
C.充电时阴极反应为LiOH+e﹣═Li+OH﹣
D.放电时正极反应为O2+2H2O+4Li++4e﹣═4LiOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)按如图所示操作,充分反应后: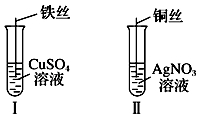
①Ⅰ中发生反应的离子方程式为;
②Ⅱ中铜丝上观察到的现象是;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为 .
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O.该反应物中还原产物是;若反应中转移了0.3mol电子,则氧化产物的质量是g.
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl﹣ , 这个事实说明FeBr2的溶液中具有还原性粒子的还原性强弱为 .
(4)黑火药爆炸时发生反应:2KNO3+S+3C═K2S+N2↑+3CO2↑,2mol KNO3氧化碳的物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碘钟”实验中,3I﹣+S2O ![]() ═I
═I ![]() +2SO
+2SO ![]() 的反应速率可以用I
的反应速率可以用I ![]() 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,得到的数据如下表:
与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,得到的数据如下表:
实验编号 | ① | ② | ③ | ④ | ⑤ |
c(I﹣)/mol/L | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
c(S2O | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
回答下列问题:
(1)该实验的目的是: .
(2)根据①、②、⑤三个实验的数据,推测显色时间t1= .
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母).
A.<22.0s
B.22.0~44.0s
C.>44.0s
D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是( )
A.2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B.200 mL 1 mol·L1氯化钙溶液中c(Cl)和100 mL 2 mol·L1氯化钾溶液中c(Cl)
C.常温下64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A.1 mol H2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1 mol任何物质体积均为22.4L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com