
| A. | 不溶物一定是铜 | |
| B. | 不溶物一定是铁 | |
| C. | 不溶物中一定含铜,但不一定含铁 | |
| D. | 滤液中一定含有FeSO4,一定没有CuSO4 |
分析 CuO和铁都可与稀硫酸反应,铁可置换出铜,向滤液中插入一枚铁钉,片刻后,取出铁钉,发现铁钉并无任何变化,说明溶液中无铜离子,以此解答该题.
解答 解:铁和稀硫酸反应生成硫酸亚铁,氧化铜和稀硫酸反应生成硫酸铜,铁与硫酸铜反应生成铜,所以不溶物中一定有铜;根据“滤出不溶物,并向滤液中插入一枚铁钉,发现铁钉并无任何变化”,稀硫酸和铜离子都完全反应,铁的反应情况有两种:一种是恰好反应,所以不溶物是铜;一种是铁过量,所以不溶物是铁和铜,
故选CD.
点评 本题以氧化铜和铁与稀硫酸的反应为载体,考查了金属活动性顺序的应用,侧重考查学生的分析能力,完成此题,可以依据金属活动性顺序以及离子之间的反应分析,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 已知CH3OH(l)的燃烧热为238.6 kJ•mol-1,则CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H=-238.6 kJ•mol-1 | |
| B. | 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 | |
| C. | 反应H2+Cl2═2HCl(△H<0)的机理包含①Cl2-→2Cl(慢),②H2+Cl-→HCl+H(快),③Cl2+H-→HCl+Cl(快),则反应①的活化能小于反应②的活化能 | |
| D. | 一定条件下反应N2+3H2?2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
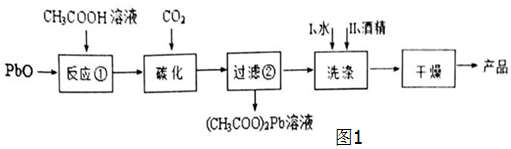
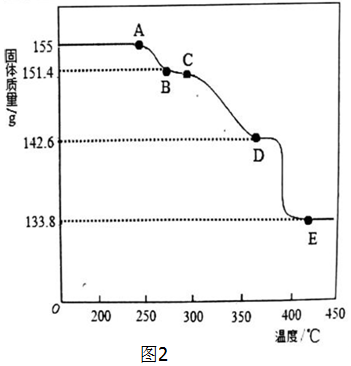
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化铝溶液中加入过量氨水:A13++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| B. | 氧化铁溶于氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O | |
| C. | 光导纤维在碱性环境中易断裂:Si+2OH-+H2O═SiO32-+2H2↑ | |
| D. | 澄清石灰水中加入过量小苏打溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
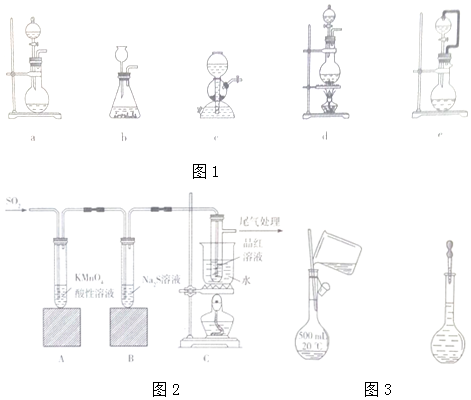
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | Cl2和NaCl中均含有氯元素,它们的化学性质相同 | |
| C. | 实验室制备Cl2可用排饱和食盐水集气法收集 | |
| D. | 氯气、液氯和氯水是一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分类是学习和研究化学物质及其变化的一种常用方法 | |
| B. | 有些液态胶体也是透明的,用肉眼很难与溶液相区别 | |
| C. | 2 L1 mol/L Na2 CO3溶液中c(Na+)为4 mol/L | |
| D. | 从1 LNaCl溶液中取出100 ml,其浓度与原1L溶液相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物的熔点一定比共价化合物熔点高 | |
| B. | 甲烷的标准燃烧热为890.3KJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| C. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件和点燃条件下的△H相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com