
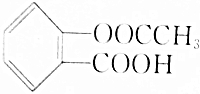
 ]与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
]与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )| A. | 0.1mol | B. | 0.2mol | C. | 0.3mol | D. | 0.4mol |
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:选择题
| A. | 沸点:乙烷>戊烷>2-甲基丁烷 | B. | 同分异构体种类:戊烷<戊烯 | ||
| C. | 密度:苯<水<硝基苯 | D. | 点燃时火焰明亮程度:乙烯>乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取乙烯时浓硫酸是催化剂和吸水剂 | |
| B. | 硝基苯制备时浓硫酸作催化剂和脱水剂 | |
| C. | 实验室制备乙烯、硝基苯、苯磺酸时均使用到温度计,且水银球在反应混合物液面以下 | |
| D. | 水浴加热的优点是可以受热均匀且便于控制温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 向100mL 3mol•L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.
向100mL 3mol•L-1的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铜与硫酸反应:Cu(OH)2+2H+=Cu2++2H2O | |
| B. | 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 氯化钡溶液与硫酸反应:Ba2++SO42-=BaSO4↓ | |
| D. | 氧化铜与硫酸反应:CuO+2H+=Cu2++H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com