
(13分)根据下面图示,回答下列问题。(已知A是常见金属单质)
(1) 写出A、B、C、D、E的化学式
A: B:
C: D:
E:
(2)按要求书写化学方程式
①EB
②放置生成D
③E具有净水作用,反应原理是________________________________
④工业上炼制A的最主要反应方程式 _________________________________
科目:高中化学 来源:连州中学2008届高三化学第二轮复习实验题训练 题型:058
在化学分析中,为了测定某试样中FeSO4·7H2O的质量分数,一般采用在酸性条件下用高锰酸钾标准溶液滴定的方法,反应原理为:5Fe2++8H++MnO4-![]() 5Fe3++Mn2++4H2O.高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+
5Fe3++Mn2++4H2O.高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+![]() 10CO2↑+2Mn2++8H2O.
10CO2↑+2Mn2++8H2O.
实验步骤如下:
步骤一:先粗配浓度约为1.5×10-2 mol·L-1的高锰酸钾溶液500 mL.
步骤二:称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用(1)所配高锰酸钾溶液进行滴定,从而可标定高锰酸钾溶液的浓度.经测定,c(KMnO4)=0.0160 mol·L-1
步骤三:称取FeSO4·7H2O试样1.073 g,放入锥形瓶中,加入适量的水溶解,
步骤四:用标准高锰酸钾溶液滴定步骤三所配样品溶液,达到终点时消耗标准溶液48.00 mL.
试回答下列问题:
(1)步骤一中要用到的玻璃仪器是烧杯、________、________.
(2)步骤二中需要对m的大致值进行预估,你预估的依据是_______________________.
(3)本实验中操作滴定管的以下图示,正确的是________(填编号).
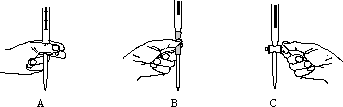
(4)步骤二的滴定是在一定温度下进行的,操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢.试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是_________________________.
(5)请在下面设计步骤四中的数据记录和数据处理表格(不必填数据).
(6)国家标准规定FeSO4·7H2O的含量(w):一级品100.5%≥w≥99.50%;二级品100.5%≥w≥99.00%;三级品101.0%≥w≥98.00%.试判断该试样符合国家________级品标准.
(7)测定试样中FeSO4·7H2O的含量时,有时测定值会超过100%,其原因可能是____________________
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)该同学准备了下列实验用品:20%NaCl溶液、蒸馏水、酚酞试液、KSCN溶液、新制氯水、纯铁丝、碳棒、U形管、导线等;请你帮他设计一实验方案来验证钢铁吸氧腐蚀的电极产物,简述操作过程并写出溶液中有关反应的离子方程式。
(2)该同学查阅有关资料知:氧气在液滴的表面和中心浓度不同;Fe2+遇K3[Fe(CN)6]产生蓝色沉淀:3Fe2++2[Fe(CN)6]3-====Fe3[Fe(CN)6]2↓(蓝色)。该同学在一块光洁无锈的铁板上滴2滴含酚酞和K3[Fe(CN)6]的NaCl溶液,在空气中放置几分钟后,发现盐水滴
边缘溶液显红色,盐水与铁板的接触面中心出现蓝色不溶物(见图示)。
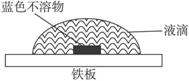
试判断该实验是否是铁的吸氧腐蚀。
若是,请写出正极反应方程式:___________________________________________________。
若否,指出产生该现象的原因:___________________________________________________。
(3)将一铜棒、碳棒用导线连接后,插入内盛20%氯化钠溶液的U形管中,请根据此装置在下面两项中择一回答:
①若不是原电池,请说明原因:_________________(如果回答此题,下面的②不用回答)。
②若是原电池,现要求利用此装置(电极材料、溶液浓度均不变),采取适当的措施来提高电池的放电效率,该操作可以是_________________。
(4)目前我国许多大型铜质文物露天放置腐蚀严重,在不影响观瞻效果的条件下,除用加保护层法保护外,请你再提出一项简单而有效的保护方法并简述其保护原理:
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
在化学分析中,为了测定某试样中FeSO4·7H2O的质量分数,一般采用在酸性条件下用高锰酸钾标准溶液滴定的方法,反应原理为:5Fe2++8H++MnO4-![]() 5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+
5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+![]() 10CO2↑+2Mn2++8H2O。
10CO2↑+2Mn2++8H2O。
实验步骤如下:
步骤一:先粗配浓度约为1.5×10-2mol·L-1的高锰酸钾溶液500 mL。
步骤二:称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用(1)所配高锰酸钾溶液进行滴定,从而可标定高锰酸钾溶液的浓度。经测定,c(KMnO4)=0.0160 mol·L-1
步骤三:称取FeSO4·7H2O试样1.073g,放入锥形瓶中,加入适量的水溶解,
步骤四:用标准高锰酸钾溶液滴定步骤三所配样品溶液,达到终点时消耗标准溶液48.00mL。
试回答下列问题:
(1)步骤一中要用到的玻璃仪器是烧杯、___________ 、 。
(2)步骤二中需要对m的大致值进行预估,你预估的依据是
___________________________________________________ 。
(3)本实验中操作滴定管的以下图示,正确的是______________(填编号)。

(4)步骤二的滴定是在一定温度下进行的,操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是 ______________________ 。
(5)请在下面空白处设计步骤四中的数据记录和数据处理表格(不必填数据)。
(6)国家标准规定FeSO4·7H2O的含量(w):一级品100.5%≥w≥99.50%;二级品 100.5%≥w ≥99.00%;三级品 101.0%≥w≥98.00%。试判断该试样符合国家________级品标准。
(7)测定试样中FeSO4·7H2O的含量时,有时测定值会超过100%,其原因可能是
_______________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,某同学拟对其原理及条件进行探究:
(1)该同学准备了下列实验用品:20%NaCl溶液、蒸馏水、酚酞试液、KSCN溶液、新制氯水、纯铁丝、碳棒、U型管、导线等;请你帮他设计一实验方案来验证钢铁吸氧腐蚀的电极产物,简述操作过程并写出溶液中有关反应的离子方程式。
 (2)该同学查阅有关资料知:氧气在液滴的表面和中心浓度不同;Fe2+遇K3[Fe(CN)6]。)产生蓝色沉淀:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色)。该同学在一块光洁无锈的铁板上滴2滴含酚酞和K3[Fe(CN)6]的NaCl溶液,在空气中放置几分钟后,发现盐水滴边缘溶液显红色,盐水与铁板的接触面中心出现蓝色不溶物(见图示)。
(2)该同学查阅有关资料知:氧气在液滴的表面和中心浓度不同;Fe2+遇K3[Fe(CN)6]。)产生蓝色沉淀:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色)。该同学在一块光洁无锈的铁板上滴2滴含酚酞和K3[Fe(CN)6]的NaCl溶液,在空气中放置几分钟后,发现盐水滴边缘溶液显红色,盐水与铁板的接触面中心出现蓝色不溶物(见图示)。
试判断该实验是否是铁的吸氧腐蚀。
若是,请写出正极反应方程式_______________________
若否,指出产生该现象的原因:________________________。
(3)将一铜棒、碳棒用导线连接后,插入内盛20%氯化钠溶液的U型管中,请根据此装置在下面两项中择一回答:
①若不是原电池,请说明原因:______________________________
(如果回答次题,下面的②不用回答)。
②若是原电池,现要求利用此装置(电极材料、溶液浓度均不变),采取适当的措施来提高电池的放电效率,该操作可以是:____________________________
(4)目前我国许多大型铜质文物露天放置腐蚀严重,在不影响观瞻效果的条件下,除用加保护层法保护外,请你再提出一项简单而有效的保护方法并简述其保护原理:___。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
在化学分析中,为了测定某试样中FeSO4?7H2O的质量分数,一般采用在酸性条件下用高锰酸钾标准溶液滴定的方法,反应原理为:5Fe2++8H++MnO4-=5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O。
实验步骤如下:
步骤一:先粗配浓度约为1.5×10-2mol?L-1的高锰酸钾溶液500 mL。
步骤二:称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配高锰酸钾溶液进行滴定,从而可标定高锰酸钾溶液的浓度。经标定,c(KMnO4)=1.6×10―2mol/L
步骤三:称取FeSO4?7H2O试样1.073g,放入锥形瓶中,加入适量的水溶解。
步骤四:用标准高锰酸钾溶液滴定步骤三所配样品溶液,达到终点时消耗标准溶液48.00mL。
试回答下列问题:
(1)步骤一中要用到的玻璃仪器是烧杯、___________ 、 。
(2)步骤二中需要对m的大致值进行预估,你预估的依据是
_______________________________________________ 。
(3)本实验中操作滴定管的以下图示,正确的是______________(填编号)。

(4)步骤二的滴定是在一定温度下进行的,操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是_________ 。
(5)请在下面空白处设计步骤四中的数据记录和数据处理表格(不必填数据)。
(6)国家标准规定FeSO4?7H2O的含量(w):一级品100.5%≥w≥99.50%;二级品100.5%≥w ≥99.00%;三级品 101.0%≥w≥98.00%。试判断该试样符合国家________级品标准。
(7)测定试样中FeSO4?7H2O的含量时,有时测定值会超过100%,其原因可能是 ________________________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com