
| A.氘原子中的质子和中子 |
| B.Na2O2固体中的阴离子和阳离子 |
| C.CO2分子中的σ键和π键 |
| D.常温下,pH=7的CH3COOH与CH3COONa混合溶液中的H+与OH- |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
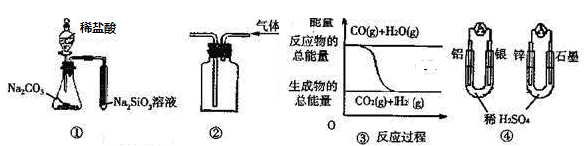
| A.用图 ① 所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
B.用图 ② 所示实验装置排空气法收集CO2气体 | C.图 ③ 表示反应 CO(g)+H2O(g) CO2(g)+H2(g)是放热反应 |
| D.图 ④ 两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:Br>Se>Cl | B.热稳定性:HCl>H2Se>HBr |
| C.酸性:H2SeO4>HBrO4>HClO4 | D.还原性:Se2—>Br—>Cl— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素Y的最高化合价为+7 |
| B.三种元素的原子半径rZ>rY>rX |
| C.Z的单质比Y的单质更易与H2反应 |
| D.化合物X2Z2中阴阳离子数之比为1: 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 键长/(pm) | B—F | B—Cl | B—Br |
| 计算值 | 152 | 187 | 199 |
| 实测值 | 130 | 175 | 187 |

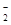 。判断HF
。判断HF 和HF
和HF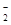 微粒间能否形成氢键,并说明理由。
微粒间能否形成氢键,并说明理由。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
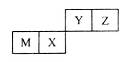
| A.Y元素气态氢化物的稳定性大于Z元素的 |
| B.M和Y两种元素,可以形成电子层结构相同的两种简单离子 |
| C.X元素最高价氧化物对应水化物的酸性弱于Y元素的 |
| D.M元素的氧化物既可以与酸溶液反应,也可以与碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Y、Z、X、W的原子序数依次减小 |
| B.X的简单氢化物的沸点低于Y的简单氢化物的沸点 |
| C.由W、X、Y、Z四种元素组成的化合物可能显强酸性 |
| D.W和X形成的化合物,与W和Y形成的化合物中各元素质量比可能相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com