
| 1 |
| K′ |
| C2(NH3) |
| C(N2)C3(H2) |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、NaCl |
| B、Al(OH)3 |
| C、CaCO3 |
| D、Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶胞是晶体结构中的基本结构单元 |
| B、晶体的外观规则,但是有些内部结构是无序的 |
| C、晶体是晶胞的堆积 |
| D、晶胞都是正八面体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
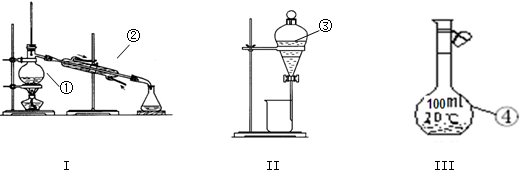


查看答案和解析>>
科目:高中化学 来源: 题型:
 铬及其化合物在工业上用重要用途,请回答下列问题:
铬及其化合物在工业上用重要用途,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
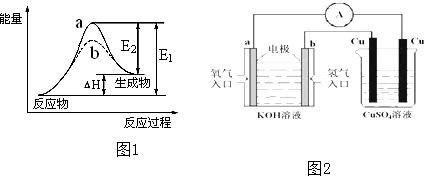
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图,X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.
如图,X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.查看答案和解析>>
科目:高中化学 来源: 题型:
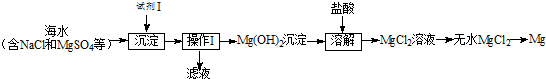
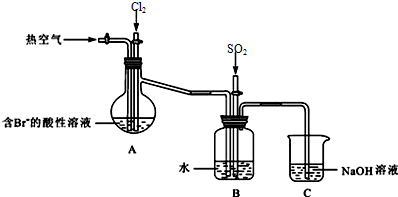
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com