
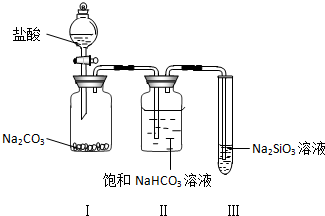
���� ��֤���ᡢ̼����������ǿ������ʵ��װ�ÿ�֪��I��������̼���Ʒ�Ӧ���ɶ�����̼��II�г�ȥHCl�����з���Na2SiO3+CO2+H2O=Na2CO3+H2SiO3�����壩���Դ������
��� �⣺��1��װ�â��з�Ӧ���ɶ�����̼�������ǹ����ܽ⣬������ð����װ�â������������װ�â��лӷ�������HCl���壬������Ӧ�����ӷ���ʽ��HCO3-+H+=H2O+CO2����
�ʴ�Ϊ�������ܽ⣬������ð��������װ�â��лӷ�������HCl���壻HCO3-+H+=H2O+CO2����
��2��װ�â��з���Na2SiO3+CO2+H2O=Na2CO3+H2SiO3�����壩���������а�ɫ��״����������
�ʴ�Ϊ����ɫ��״����������Na2SiO3+CO2+H2O=Na2CO3+H2SiO3�����壩��
��3����ʵ���֪����ʵ�鷢��ǿ����ȡ����ķ�Ӧ�������Ϊ���ԣ����̼����ᣬ�ʴ�Ϊ�����ԣ����̼����ᣮ
���� ���⿼������ʵ�鷽������ƣ�Ϊ��Ƶ���㣬����ʵ��ԭ����ʵ��װ�õ�����Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬��Ŀ�ѶȲ���


 �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д� Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�2.24LSO3����ԭ������1L0.1mol•L-1Na2SO3��Һ����ԭ������ͬ | |
| B�� | 1mol•L-1FeCl3��Һȫ���Ƴɽ��壬���к���������ĿС��NA | |
| C�� | 1molNa2O2���NA�������� | |
| D�� | 1L0.5mol•L-1Na2SO4��Һ�����������������ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �û����Һ���У�c��Na+��+c��H+��=c��HC2O4-��+c ��OH-��+2 c ��C2O42-�� | |
| B�� | �û����Һ���У�c ��Na+��=2 ��c��HC2O4-��+c ��H2C2O4��+c ��C2O42-���� | |
| C�� | �û����Һ���У�c ��OH-��-c��H+��=c��HC2O4-��+2 c ��H2C2O4�� | |
| D�� | �û����Һ���У�c ��Na+����c ��C2O42-����c��HC2O4-����c ��OH-����c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
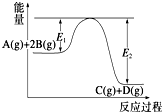
| A�� | �÷�ӦΪ���ȷ�Ӧ | |
| B�� | ����Ӧ�ﵽƽ��ʱ�������¶ȣ�A��ת�������� | |
| C�� | �����¶ȣ�ƽ�ⳣ��K��С��ѹǿ����ƽ��������Ӧ�����ƶ� | |
| D�� | �����������Ӧ��������E1��С��E2��С����Ӧ�ȼ�С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������Һ | B�� | ��ˮʪ�� | C�� | ���������� | D�� | �Ӹ����ʹ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2N2H4��g��+N2O4��g���T3N2��g��+4H2O��g������H=-542.7 kJ/mol | |
| B�� | 2N2H4��g��+N2O4��g���T3N2��g��+4H2O��g������H=-1059.3 kJ/mol | |
| C�� | N2H4��g��+$\frac{1}{2}$N2O4��g���T$\frac{3}{2}$N2��g��+2H2O��g������H=-1076.7 kJ/mol | |
| D�� | 2N2H4��g��+N2O4��g���T3N2��g��+4H2O��g������H=-1076.7 kJ/mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com