
下列各组物质混合后,再加热蒸干并在300℃时充分灼烧至质量不变,最终一定能得到纯净物的是
A.向FeSO4溶液中通入过量Cl2
B.向NaHCO3溶液中加入一定质量的Na2O2粉末
C.向NaI和NaBr混合溶液中通入过量Cl2
D.向NaOH溶液中加入过量AlCl3
科目:高中化学 来源:2017届浙江省名校协作体高三上学期联考化学试卷(解析版) 题型:选择题
反应物X转化为Y和Z的能量变化如图所示,下列说法正确的是

A.由X→Y反应的ΔH=E5?E2
B.由X→Z反应的ΔH>0
C.由图可知等物质的量的Y的能量一定比X的能量高
D.升高温度可提高X→Z的反应速率
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高二上第一次月考化学卷(解析版) 题型:填空题
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式____________________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)==2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)== N2(g)+2H2O (g);△H= -534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式_____________。
(5)已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-543kJ/mol
1/2H2(g)+1/2F2(g)=HF(g) △H=-269kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H=-242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:
______________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高二上第一次月考化学卷(解析版) 题型:选择题
氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为
H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ/mol
C8H18(l)+25/2 O2(g)=8CO2(g)+9H2O(l) △H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是
A. H2(g)  B. CO(g) C. C8H18(l) D. CH4(g)
B. CO(g) C. C8H18(l) D. CH4(g)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上10月月考化学试卷(解析版) 题型:实验题
用已知浓度的HCl溶液测定未知浓度的氨水,选用的指示剂_____________
(2)取体积相同的、物质的量浓度相同的两分NaOH溶液,把其中的一份放空气中一段时间后。用已知浓度的硫酸中和上述这两份溶液,若中和第一份(放在空气中一段时间)所消耗硫酸溶液体积为V1,另一份消耗硫酸溶液体积为V2,
①若以甲基橙为指示剂时,V1和V2的关系是_ ___
②若以酚酞为指示剂时,V1和V2的关系是__ ____
(3)用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用 0.20mol·L-1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
| NaOH起始读数 | NaOH终点读数 |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 18.00mL |
①根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1.
②达到滴定终点的标志是_______________
③以下操作造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上10月月考化学试卷(解析版) 题型:选择题
下列各选项中所述的两个量,前者一定大于后者的是
A.0.10mol·L-1的醋酸溶液和0.01mo·L-1的醋酸溶液中水的电离度
B.将pH=4的盐酸和醋酸分别稀释成pH=5的溶液,所加水的量
C.物质的量浓度相等的(NH4)2SO4溶液和(NH4)2SO3溶液中NH4+的浓度
D.物质的量浓度相等的CH3COONa溶液和 Na2CO3溶液的pH
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上10月月考化学试卷(解析版) 题型:选择题
对于可逆反应:2SO2(g)+O2(g) 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
A.增大压强 B.升高温度 C.使用催化剂 D.多充入O2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学试卷(解析版) 题型:选择题
T ℃时,在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论不正确的是
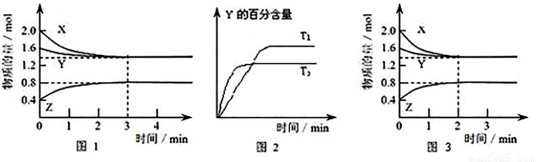
A.容器中发生的反应可表示为:3X(g)+Y(g)  2Z(g)
2Z(g)
B.反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L·min)
C.据图2可知,相对于T1,温度为T2时更快达到“拐点”,说明T2时化学反应速率更快,可确定温度T2高于T1
D.若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用了催化剂
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上学期第二次月考化学试卷(解析版) 题型:选择题
锑(Sb)在自然界一般以硫化物的形式存在。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原①2Sb2S3+3O2+6Fe=Sb4O6+6FeS ②Sb4O6+6C=4Sb+6CO,下列关于反应①、②的说法正确的是
A.反应①②中的氧化剂分别是Sb2S3、Sb4O6
B.反应①中每生成3molFeS时,共转移6mol电子
C.反应②说明高温下Sb的还原性比C强
D.每生成4molSb时,反应①与反应②中还原剂的物质的量之比为3:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com