
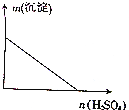
 向某分散系中逐滴加入硫酸,测得溶液中沉淀的质量与加入硫酸的物质的量的关系如图所示,则该分散系可能是( )
向某分散系中逐滴加入硫酸,测得溶液中沉淀的质量与加入硫酸的物质的量的关系如图所示,则该分散系可能是( )| A. | 硝酸钙与硫酸钾的混合液 | B. | 氯化钡与碳酸钠的混合液 | ||
| C. | 硫酸镁与氢氧化钾的混合液 | D. | 氯化铝与硝酸钠的混合液 |
分析 由图可知,随着硫酸的加入沉淀的质量逐渐减少,最后全部消失,则原来混合溶液会生成难溶于硫酸的沉淀.
解答 解:由图可知,随着硫酸的加入沉淀的质量逐渐减少,最后全部消失,则原来混合溶液会生成难溶于硫酸的沉淀,
A.硝酸钙与硫酸钾的混合液生成硫酸钙沉淀,硫酸钙不溶于硫酸,最后沉淀不消失,故A错误;
B.氯化钡与碳酸钠的混合液生成碳酸钡沉淀,加硫酸,生成硫酸钡沉淀,最后沉淀不消失,故B错误;
C.硫酸镁与氢氧化钾的混合液生成氢氧化镁沉淀,加硫酸,沉淀逐渐溶解,最后完全消失,故C正确;
D.氯化铝与硝酸钠的混合液没有沉淀生成,加硫酸,没有现象,故D错误.
故选C.
点评 本题考查了物质的性质,题目难度不大,注意分析题目中所给图象中包含的信息.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用丁达尔效应鉴别Fe(OH)3胶体和淀粉溶液 | |
| B. | 用渗析的方法除去淀粉胶体含有少量NaCl | |
| C. | 用溶解、过滤、洗涤固体的方法提纯含有少量BaSO4的Na2CO3 | |
| D. | 用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
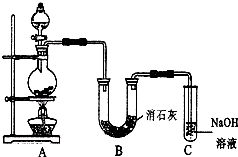 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com