
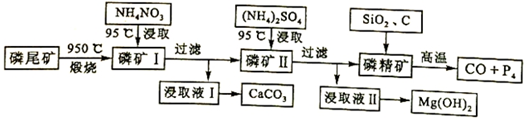
分析 磷尾矿[主要含Ca5(PO4)3F和CaCO3•MgCO3]在950℃下煅烧,其中碳酸钙和碳酸镁分解,生成气体的成分为二氧化碳(CO2),磷矿Ⅰ的主要成分为Ca5(PO4)3F、CaO、MgO,NH4NO3溶液中铵离子水解呈酸性,可溶解CaO,得到的浸取液Ⅰ含有Ca2+,可生成CaCO3,磷矿Ⅱ含有Ca5(PO4)3F、MgO,加入硫酸铵浸取,浸取液Ⅱ含有镁离子,可生成氢氧化镁,磷精矿加入二氧化硅、C等,在高温下发生4Ca5(PO4)3F+18SiO2+30C$\frac{\underline{\;高温\;}}{\;}$2CaF2+30CO+18CaSiO3+3P4,可生成P4,以此解答该题.
解答 解:(1)根据题给化学工艺流程和信息①知磷尾矿[主要含Ca5(PO4)3F和CaCO3•MgCO3]在950℃下煅烧,其中碳酸钙和碳酸镁分解,生成气体的成分为二氧化碳(CO2),故答案为:二氧化碳(CO2);
(2)实验室过滤所需的玻璃仪器是烧杯、漏斗和玻璃棒,故答案为:烧杯、漏斗和玻璃棒;
(3)NH4NO3溶液中铵离子水解呈酸性,H+能从磷矿I中浸取出Ca2+,故答案为:NH4+水解使溶液呈酸性,与CaO、Ca(OH)2反应生成Ca2+;
(4)根据化学工艺流程判断浸取液II的主要成分为硫酸镁溶液,通入NH3,发生反应的化学方程式是MgSO4+2NH3+2H2O=Mg(OH)2↓+(NH4)2SO4,
故答案为:MgSO4+2NH3+2H2O=Mg(OH)2↓+(NH4)2SO4;
(5)已知25℃,101kPa时:
①CaO(s)+H2SO4(l)═CaSO4(s)+H2O(l)△H=-271kJ/mol
②5CaO(s)+3H3PO4(l)+HF(g)═Ca5(PO4)3F(s)+5H2O(l)△H=-937kJ/mol
根据盖斯定律:①×5-②得Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是Ca5(PO4)3F (s)+5H2SO4(l)=5CaSO4(s)+3H3PO4(l)+HF(g)△H=-418kJ/mol,
故答案为:Ca5(PO4)3F (s)+5H2SO4(l)=5CaSO4(s)+3H3PO4(l)+HF(g)△H=-418kJ/mol.
点评 本题考查物质的制备,为高考常见题型,注意掌握实验的原理和流程,试题计算量较大,充分培养了学生的分析、理解能力及化学计算能力,题目难度较大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 117号元素最高正价应为+7 | |
| B. | 核素293117Ts中中子数与质子数之差为176 | |
| C. | 117号元素衰变成115号元素和113号元素是化学变化 | |
| D. | 117号与115号元素的原子质量比为117:115 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol/L的NaHA其PH=1,溶液中存在:c(Na+)+c(H+)=c(OH-)+2c(A2-)+c(HA-) | |
| B. | 40%的醋酸溶液(p=1.049gcm-3)与60%的醋酸溶液(p=1.064gcm-3)等体积混合后,所得溶液中溶质的质量分数大于50% | |
| C. | 0.1mol/L的醋酸溶液V1L和等浓度的氢氧化钠溶液V2L混合后呈碱性,则一定有V1≤V2 | |
| D. | 1L0.5mol/LFeCl3的溶液与0.2L1mol/LKCl溶液中Cl-数目之比为15:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子中的6个碳原子之间的键完全相同,是一种介于碳碳单键和碳碳双键之间独特的键 | |
| B. | 将溴水加入苯中,溴水的颜色变浅,这是由于发生了加成反应 | |
| C. | 乙烷和丙烯的物质的最共1mol,完全燃烧后生成3molH2O | |
| D. | 主链上有5个碳原子的庚烷有5 种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③ | C. | ①③ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 4:2:1 | C. | 2:3:4 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com