
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是___(多选扣分)。
a.υ正(H2)=υ逆(H2O) b.反应停止,正、逆反应速率都等于零
c.容器中压强不再发生变化 d.混合气体中c(CO2)不变
(4)某温度下,在2L的密闭容器中,加入1 molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试判断此时的温度为__℃。
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,CO2的平衡转化率为___。
【答案】![]() 吸热 ad 830℃ 60%
吸热 ad 830℃ 60%
【解析】
(1)化学平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值;
(2)根据平衡常数K和温度t的关系进行判断;
(3)反应达到平衡状态时,正反应速率等于逆反应速率,各物质的浓度不发生变化;
(4)根据三段法计算出平衡时各物质的浓度,求出平衡常数,与表格中数据进行对比,找到温度;
(5)温度不变,平衡常数不发生变化,根据三段法进行计算。
(1)化学平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值,即K=![]() ;
;
(2)由表格中的数据可知,温度升高,平衡常数增大,则该反应为吸热反应;
(3)a.υ正(H2)=υ逆(H2O),说明反应达到了平衡状态,a项正确;
b.反应达到的平衡状态是动态的平衡,反应并没有停止停止,正反应速率和逆反应速率不等于零,b项错误;
c.该反应为等体积反应,容器中压强不再发生变化,不能证明反应达到平衡状态,c项错误;
d.混合气体中c(CO2)不变,说明反应达到了平衡状态,d项正确;
答案选ad;
(4) CO2(g)+H2(g)![]() CO(g)+ H2O(g)
CO(g)+ H2O(g)
始(mol/L) 0.5 0.5 0 0
转(mol/L) 0.25 0.25 0.25 0.25
平(mol/L) 0.25 0.25 0.25 0.25
平衡常数K=![]() =
=![]() =1,因此反应的温度为830℃;
=1,因此反应的温度为830℃;
(5) CO2转化了xmol/L,则
CO2(g)+H2(g)![]() CO(g)+ H2O(g)
CO(g)+ H2O(g)
始(mol/L) 1 1.5 0 0
转(mol/L) x x x x
平(mol/L) 1-x 1.5-x x x
平衡常数K=![]() =
=![]() =1,解得x=0.6mol/L
=1,解得x=0.6mol/L
CO2的平衡转化率=![]() ×100%=60%。
×100%=60%。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
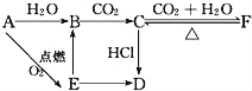
(1)写出A、B、C、D、E、F的化学式:
A.___,B.___,C.___,D.___,E.___,F.___。
(2)写出有关反应的化学方程式(是离子反应的直接写离子方程式)。
A→E:___,
E→B:___,
F→C:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是( )
A. 现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3∶2∶1
B. 28 g CO和22.4 L CO2中含有的碳原子数一定相等
C. 标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D. a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在101kPa、25℃条件下,2 mol氢气完全燃烧生成水蒸气放出484kJ的热量,下列热化学方程式正确的是( )
A.H2O(g)=H2(g)+![]() O2(l) △H=+242kJ/mol
O2(l) △H=+242kJ/mol
B.2H2 (g)+O2(g)=2H2O(l) △H=-484kJ/mol
C.H2(g)+![]() O2(g)=H2O(g) △H=-242kJ/mol
O2(g)=H2O(g) △H=-242kJ/mol
D.2H2(g)+O2(g)=2H2O(g) △H=+484kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
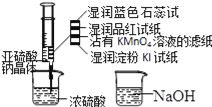
A. 湿润淀粉碘化钾试纸未变蓝说明硫元素的非金属性强于碘元素
B. 沾有KMnO4溶液的滤纸褪色证明了SO2具有漂白性
C. 实验后,可把注射器中的物质缓缓推入NaOH溶液中,以减少环境污染
D. 蓝色石蕊试纸变红说明SO2显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
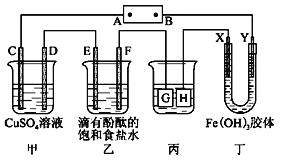
请回答:(1)B极是电源的___极,电极C的电极反应式为:___。
(2)若C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为___。
(3)现用丙装置给铜件镀银,则H电极材料是___(填“铜”或“银”),电镀液是___溶液。当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为___。
(4)一段时间后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明__在电场作用下向Y极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等,其中HClO2和ClO2都具有漂白作用.已知pOH=﹣lgc(OH﹣),经测定25℃时各组分含量随pOH变化情况如图所示(Cl﹣没有画出),此温度下,下列分析正确的是
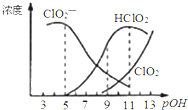
A.HClO2的电离平衡常数的数值Ka=10﹣6
B.亚氯酸钠在酸性条件下较稳定
C.pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2﹣)>c(ClO2)>c(Cl﹣)
D.同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)-2c(H+)=c(ClO2﹣)-2c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Al、CuO、Fe2O3组成的混合物共10.0g,放入500mL某浓度的盐酸中,混合物完全溶解,当再加入250mL 2.00mol/L的NaOH溶液时,得到沉淀最多。上述盐酸的浓度为( )
A. 1.00 mol/LB. 0.500 mol/L
C. 2.00 mol/LD. 3.00 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com