

分析 Fe、Cu、Fe2O3都不与NaOH溶液反应,Al和Al2O3可与NaOH溶液反应,用含有Al、Fe、Cu和Al2O3和Fe2O3的废金属屑制取AlCl3、绿矾晶体(FeSO4•7H2O)和胆矾晶体流程为:合金中Al、Al2O3与NaOH反应,所得滤液A为NaAlO2溶液,经途径Ⅱ与足量二氧化碳发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,反应可生成Al(OH)3固体C,生成的Al(OH)3再和盐酸反应生成AlCl3,得到的AlCl3较纯净;溶液D为NaHCO3溶液;
滤渣B为Fe和Cu的化合物,加入足量稀硫酸,得到的滤液E为FeSO4,经蒸发浓缩、冷却结晶可得到绿矾,滤渣F为Cu,可用于制备胆矾,气体G为氢气.
解答 解:Fe、Cu、Fe2O3都不与NaOH溶液反应,Al和Al2O3可与NaOH溶液反应,用含有Al、Fe、Cu和Al2O3和Fe2O3的废金属屑制取AlCl3、绿矾晶体(FeSO4•7H2O)和胆矾晶体流程为:合金中Al、Al2O3与NaOH反应,所得滤液A为NaAlO2溶液,经途径Ⅱ与足量二氧化碳发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,反应可生成Al(OH)3固体C,生成的Al(OH)3再和盐酸反应生成AlCl3,得到的AlCl3较纯净;溶液D为NaHCO3溶液;
滤渣B为Fe和Cu的化合物,加入足量稀硫酸,得到的滤液E为FeSO4,经蒸发浓缩、冷却结晶可得到绿矾,滤渣F为Cu,可用于制备胆矾,气体G为氢气.
(1)铝、氧化铝与氢氧化钠反应,所得滤液A为NaAlO2溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑、Al2O3+2OH-=2AlO2-+H2O,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑、Al2O3+2OH-=2AlO2-+H2O;
(2)金属铁和金属铜不与氢氧化钠反应,金属铜和稀硫酸之间不反应,但是金属铁可以和稀硫酸之间反应生成硫酸亚铁和氢气,进而制的绿矾晶体,所以试剂X为稀硫酸;溶液D为NaHCO3溶液,
故答案为:稀硫酸;碳酸氢钠;
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂将制得的CO2气体通入溶液A中.一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是二氧化碳气体中含有从盐酸中挥发出的HCl气体,氯化氢在水中溶解了部分沉淀,发生的反应为Al(OH)3+3H+=Al3++3H2O,为了避免固体C减少,可在制取二氧化碳的收集装置中增加一个洗去HCl的装置,二氧化碳在饱和NaHCO3中不溶,氯化氢和NaHCO3反应生成二氧化碳气体,所以可在装置a和b之间增加一个盛有饱和NaHCO3溶液的洗气瓶,除去二氧化碳中的氯化氢,
故答案为:a,b间加一个盛有饱和NaHCO3的洗气瓶,以除去HCl;
(4)溶液E中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,原因是Fe3+被Fe还原生成Fe2+,所以加入KSCN溶液没有明显现象,发生2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(5)由CuSO4溶液得到胆矾,可经过加热浓缩、冷却结晶、过滤等操作,故答案为:加热浓缩、冷却结晶、过滤.
点评 本题考查物质制备,为高频考点,涉及氧化还原反应、化学方程式的计算、离子检验、基本操作等知识点,明确化学反应原理及物质性质、基本操作是解本题关键,知道流程图中可能存在的反应及基本操作方法,知道每一种物质的成分,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数为2的元素 | |
| B. | 原子序数为48的元素 | |
| C. | 原子核外L层比M层多一个电子的元素 | |
| D. | 原子核外M层有8个电子的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:5:4 | B. | 2:1:2 | C. | 1:1:1 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
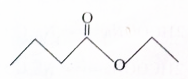
| A. | X难溶于乙醇 | |
| B. | 酒中的少量丁酸能抑制X的水解 | |
| C. | 分子式为C4H8O2且官能团与X相同的物质共有5种 | |
| D. | X完全燃烧后生成CO2和H20的物质的量比为1:2. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,CuS的溶解度大于ZnS的溶解度 | |
| B. | 25℃时,向含有等物质的量的FeCl2、CuCl2的混合液中逐滴加入Na2S,最先出现沉淀的是FeS | |
| C. | 除去ZnCl2溶液中的Cu2+,可以选用FeS作沉淀剂 | |
| D. | 将足量CuSO4溶解在0.1mol/L的H2S溶液中,S2-能达到的最大浓度为$\sqrt{1.3}×{10^{-18}}mol/L$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO?) | |
| B. | 常温下,pH=2的CH3COOH溶液与pH=12的NaOH 溶液等体积混合后溶液的pH=7 | |
| C. | CH3COOH溶液中加入少量CH3COONa固体.平衡逆向移动 | |
| D. | 室温下向pH=3的醋酸溶液中加水稀释,溶液中$\frac{[C{H}_{3}CO{O}^{-}]}{[C{H}_{3}COOH][O{H}^{-}]}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com