
��֪��Ӧ��2CH3OH(g)CH3OCH3(g)��H2O(g)��ij�¶��µ�ƽ�ⳣ��Ϊ400���ڴ��¶��£����ܱ������м���һ����CH3OH����Ӧ��5 minʱ��ø���ֵ�Ũ�������ʾ��
| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/mol·L��1 | 0.44 | 0.6 | 0.6 |
(1)�÷�Ӧ�ڵ�����(��ʱˮΪҺ̬)���Է����У���÷�Ӧ�Ħ�H______0(���������������������ͬ)��
(2)�Ƚϴ�ʱ�����淴Ӧ���ʵĴ�С��v��______v�档
(3)ǰ5 minʱ����CH3OCH3��ʾ�÷�Ӧ������Ϊ________________��
(4)�ٹ�һ��ʱ���Ӧ�ﵽƽ��״̬�����жϸ÷�Ӧ�Ѵﵽ��ѧƽ��״̬��������__________(����ĸ)��
A��������ѹǿ����
B�����������c(CH3OH)����
C��v����(CH3OH)��2v����(H2O)
D��c(CH3OCH3)��c(H2O)
(5)�ﵽƽ��״̬ʱ��CH3OH��ת����Ϊ__________��
�𰸡�(1)����(2)����(3)0.12 mol·L��1·min��1��(4)B��(5)97.6%
������(1)�÷�Ӧ�ڵ��������Է����У��Ҧ�S��0���ʿ�֪��H��0��(2)��ʱ��Ũ����Q����1.86��K����Ӧ������У���v ����v �档(3)��CH3OCH3��ʾ�÷�Ӧ������Ϊ��0.12 mol·L��1·min��1��(4)�жϷ�Ӧ�ﵽ��ѧƽ��״̬�����ݣ�һ��v����v�棬Cѡ��������CH3OHʱ��������У�����H2OҲ��������У������жϣ����Ǹ���ֵ�Ũ�ȱ��ֲ��䣬����һ����ȣ���ѡ��B�����жϣ���ѡ��D�������жϣ���������������÷�Ӧǰ����������ʵ������䣬������ѹǿʼ�ղ��䣬��ѹǿ���䲻����Ϊ�ж����ݡ�(5)�ɱ������ݵã���ʼʱc(CH3OH)��0.44 mol·L��1��0.6 mol·L��1��2��1.64 mol·L��1����ﵽƽ��״̬ʱH2O��Ũ��Ϊx mol·L��1�����ݡ�����ʽ���ɵ�ƽ��ʱCH3OH��CH3OCH3��H2O��Ũ�ȷֱ�Ϊ(1.64��2x)mol·L��1��x mol·L��1��x mol·L��1������K����400�����x��0.8����CH3OH��ת����Ϊ��100%��97.6%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ӻ�ѧ���Ĺ۵㿴����ѧ��Ӧ��ʵ���ǡ��ɼ��Ķ��ѣ��¼����γɡ����ݴ�����Ϊ���б仯���ڻ�ѧ�仯���� (����)
�ٶԿ������н��¼�ѹ���ڽ��ʯ���ʯī����NaCl�ۻ����ܵ�����CCl4�С���HCl����ˮ�����H����Cl����������ڵ�Al2O3��ȡAl
A���ڢۢ� B���ڢݢ�
C���ڢ� D���ڢۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�¶��£����ܱ�������SO2��O2��SO3������̬���ʽ�����ѧƽ��ı������Է�Ӧ2SO2(g)��O2(g)2SO3(g)����H<0�������淴Ӧ���ʵ�Ӱ����ͼ��ʾ��
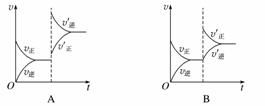
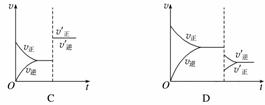
(1)�Ӵ����Է�Ӧ����Ӱ���ͼ����________(����ţ���ͬ)��ƽ��________�ƶ���
(2)�����¶ȶԷ�Ӧ����Ӱ���ͼ����__________��ƽ����________�����ƶ���
(3)����Ӧ��������Է�Ӧ����Ӱ���ͼ����________��ƽ����________�����ƶ���
(4)����O2��Ũ�ȶԷ�Ӧ����Ӱ���ͼ����__________��ƽ����________�����ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
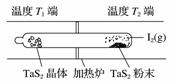
��ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�á����á���ѧ����ת�Ʒ����Ʊ�TaS2���壬�������·�Ӧ��TaS2(s)��2I2(g)TaI4(g)��S2(g)����H��0(��)����ͼ��ʾ����Ӧ(��)��ʯӢ��չ��н��У������¶�ΪT2��һ�˷���δ�ᴿ��TaS2��ĩ������I2(g)��һ��ʱ������¶�ΪT1��һ�˵õ��˴���TaS2���壬���¶�T1________T2(�>������<������)��������Ӧ��ϵ��ѭ��ʹ�õ�������________��
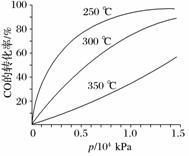
(2)[2011·ɽ�����ۣ�28(3)]CO�����ںϳɼ״�����Ӧ����ʽΪCO(g)��2H2(g)CH3OH(g)��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ��ʾ���÷�Ӧ��H______0(�>����<��)��ʵ����������������250 �桢1.3��104 kPa���ң�ѡ���ѹǿ��������________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪2SO2(g)��O2(g)2SO3(g)����H��Q(Q��0)����ͬ�¡�ͬ�������������ܱ������зֱ�������壺(��)2 mol SO2��1 mol O2��(��)1 mol SO2�� 0.5 mol O2��(��)2 mol SO3�����¡������·�Ӧ��ƽ��ʱ�����й�ϵһ����ȷ����(����)
A��������ѹǿp��p�ף�p����2p��
B��SO3������m��m�ף�m����2m��
C��c(SO2)��c(O2)֮��k��k�ף�k����k��
D����Ӧ�ų���������������ֵQ��Q�ף�Q����2Q��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ۺ���ͼ�жϣ�������������ȷ����
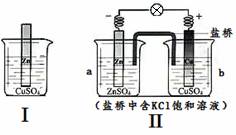
A. ��ķ�Ӧԭ������Zn + Cu2+ = Zn2+ + Cu
B. ���о��е���ת�ƣ����ǰѻ�ѧ��ת��Ϊ��������
C. ���ŷ�Ӧ�Ľ��У�����CuSO4��Һ��ɫ��������dz
D. ȡa����Һ��������Ba(NO3)2��Һ�����˺�����Һ�м�AgNO3��Һ���г�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���飨C3H8���ͱ�ϩ��C3H6�����������ȼ�ϡ�
��1����������ɵñ�ϩ��
��֪��C3H8(g)��CH4(g)��HC
 CH(g)��H2(g) ��H1=��156.6 kJ��mol��1
CH(g)��H2(g) ��H1=��156.6 kJ��mol��1
CH3CH
 CH2(g)��CH4(g)��HC
CH2(g)��CH4(g)��HC
 CH(g ) ��H2=��32.4 kJ��mol��1
CH(g ) ��H2=��32.4 kJ��mol��1
����ͬ�����£���ӦC3H8(g)=CH3CH
 CH2(g)��H2(g) �ġ�H= kJ��mol��1��
CH2(g)��H2(g) �ġ�H= kJ��mol��1��
��2���Ա���Ϊȼ����������ȼ�ϵ�أ���ص�����ͨ��O2��CO2������ͨ����飬�����������̼���Ρ���ظ�����ӦʽΪ ���ŵ�ʱCO32�������ص� �����������������
��3��̼�⻯������ȫȼ������CO2��H2O�����³�ѹ�£������е�CO2����ˮ���ﵽƽ��ʱ����Һ��pH=5.60��c(H2CO3)=1.5��10-5 mol��L��1��������ˮ�ĵ��뼰H2CO3�ĵڶ������룬��H2CO3 HCO3����H����ƽ�ⳣ��K1= ������֪10-5.60=2.5��10-6��
HCO3����H����ƽ�ⳣ��K1= ������֪10-5.60=2.5��10-6��
��4�������£�0.1 mol��L��1NaHCO3��Һ��pH����8������Һ�У�
��c(OH-)= ��
��c(H2CO3) c(CO32��)�����������=����������ԭ���� �������ӷ���ʽ�ͱ�Ҫ������˵������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ѧ����ʵ�������������ȷ���� (����)��
A����������Ͷ�뵽һ������ϡ�����У���ַ�Ӧ��ȡ�ϲ���Һ���Թ��У��μ�KSCN��Һ����Һ��Ѫ��ɫ
B���Ʊ�����������ʱ��������������Һ�еμ�����������Һ���ӱ߽��裬�����Ƶð�ɫ������������
C�������ש�е��������ɷ֣����ש��ĩ�м������ᣬ��ַ�Ӧ��ȡ�ϲ���Һ���Թ��У��μ�KSCN��Һ2��3�μ���
D����CuSO4��Һ�е������NaOH��Һ��ַ�Ӧ�����Һ�嵹���������м������һ�ᣬȻ����ȴ�����ˣ���ֽ�ϵ�����Ϊ����ɫ���塱
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������10 mL pH��3�Ĵ�����Һ�м�ˮϡ�ͺ�����˵����ȷ����(����)
A����Һ�е������ӵ���Ŀ����
B����Һ��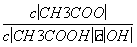 ����
����
C������ĵ���̶�����c(H��)������
D���ټ���10 mL pH��11��NaOH��Һ�����ҺpH��7
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com