
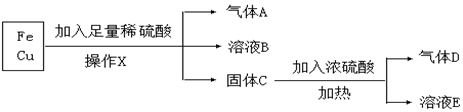
分析 向铁、铜混合物中加入足量稀硫酸时,铁和稀硫酸反应生成硫酸亚铁、氢气,铜和稀硫酸不反应,所以A是氢气,B是硫酸亚铁溶液,C是Cu,采用过滤的方法分离不溶性固体和溶液;
在加热条件下,铜和浓硫酸反应生成硫酸铜、二氧化硫和水,所以D是二氧化硫、E是硫酸铜,
再结合物质的性质分析解答.
解答 解:向铁、铜混合物中加入足量稀硫酸时,铁和稀硫酸反应生成硫酸亚铁、氢气,铜和稀硫酸不反应,所以A是氢气,B是硫酸亚铁溶液,C是Cu,采用过滤的方法分离不溶性固体和溶液;
在加热条件下,铜和浓硫酸反应生成硫酸铜、二氧化硫和水,所以D是二氧化硫、E是硫酸铜,
(1)分离不溶性固体和溶液的方法为过滤,所以操作X的名称是过滤,故答案为:过滤;
(2)通过以上分析知,气体D是SO2,故答案为:SO2;
(3)A是氢气,氢气与氧化铜加热反应生成铜和水,反应方程式为:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,该反应中H元素化合价由0价变为+1价,所以氢气是还原剂,
故答案为:还原剂;
(4)溶液B中的金属阳离子是亚铁离子,溶液E是硫酸铜溶液,溶液E中阴离子除了OH-外还有硫酸根离子,
故答案为:Fe2+;SO42-.
点评 本题以物质的分离、提纯为载体考查了无机物的推断,根据物质的性质结合物质间的反应来推断,知道每一步发生的反应,并结合基本概念降低,难度不大.


科目:高中化学 来源:2016-2017学年河北省唐山市高二上10月月考化学试卷 (解析版) 题型:选择题
用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g);ΔH=-1 160 kJ·mol-1
下列说法不正确的是( )
A.若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ
B.CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1
C.反应①②转移的电子数相同
D.反应② 中当4.48 L CH4反应完全时转移的电子总数为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| B. | 1一氯丙烷中加入氢氧化钠溶液并加热:CH3CH2CH2Cl+NaOH$→_{△}^{水}$CH3CH=CH2↑+NaCl+H2O | |
| C. | 甲醛溶液中加入足量新制碱性Cu(OH)2悬浊液并加热HCHO+2 Cu(OH)2+NaOH$\stackrel{△}{→}$HCOONa+Cu2O↓+3H2O | |
| D. | 向小苏打溶液中加入醋酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①④ | C. | ②③⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
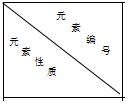 | ① | ② | ③ | ④ | ⑤[ | ⑥ | ⑦ | ⑧ |
| 原子半径/10-10m | 0.66 | 1.36 | 1.23 | 1.10 | 0.99 | 1.54 | 0.70 | 1.18 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 负化合价 | -2 | -3 | -1 | -3 |
| A. | 元素①⑧形成的化合物具有两性 | |
| B. | 元素⑦位于第二周期Ⅴ族 | |
| C. | 元素④⑤形成的化合物是离子化合物 | |
| D. | 元素⑥的最高价氧化物对应水化物碱性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将铜粉加入1.0mol•L-1Fe2(SO4)3溶液中 | 铜粉溶解 | 金属铜比铁活泼 |
| B | 将pH试纸放在玻片上,用玻璃棒蘸取某新制氯水,点在pH试纸中央,与标准比色卡对照 | pH=2 | 氯气与水反应生成了强酸 |
| C | 向含有Fe2+的MgSO4溶液中,先加H2O2溶液,然后再调溶液的pH约为5 | 有红褐色沉淀生成 | Fe2+被H2O2氧化为Fe3+ |
| D | 将KI和FeCl3溶液在试管中混合后,加入汽油,振荡,静置 | 下层溶液显紫红色 | 生成的I2全部溶于汽油中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 进行硫酸铜溶液的浓缩结晶实验需要的仪器主要有烧杯、玻璃棒、蒸发皿 | |
| B. | 用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体 | |
| C. | 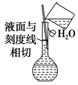 按图所示配制溶液 | |
| D. | 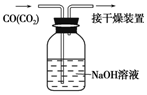 按如图可除去CO中混有的CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①是置换反应 | B. | 反应②是复分解反应 | ||
| C. | 反应①中TiO2是氧化剂 | D. | 反应②中金属镁是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com