
下列离子方程式书写正确的是( )
A.已知电离常数H2SO3 K1=1.3×10-2 K2=6.3×10-8;H2CO3 K1=4.2×10-7 K2=5.6×10-11。
H2SO3溶液和NaHCO3溶液反应:H2SO3+2HCO3-=SO32-+2CO2↑+2H2O
B.控制pH为9~10,用NaClO溶液将含NaCN的废水中的CN-氧化为两种无污染的气体:
2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O
C.已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色溶液。当Pb(CH3COO)2溶液中通入H2S气体时有黑色沉淀生成:Pb2++H2S=PbS↓+2H+
D.CuSO4溶液与过量浓氨水反应:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源:2017届江苏省无锡市三校联合体高三上第一次月考化学试卷(解析版) 题型:实验题
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
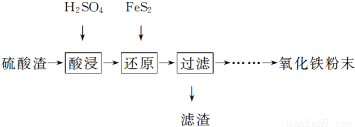
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率。② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO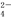 ,该反应的离子方程式为 。
,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量,以控制加入FeS2的量。实验步骤为准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-===2Fe2++SnCl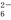
Sn2++4Cl-+2HgCl2===SnCl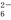 +Hg2Cl2↓
+Hg2Cl2↓
6Fe2++Cr2O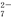 +14H+===6Fe3++2Cr3++7H2O
+14H+===6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”或“不变”,下同)
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有的Fe3+。产生Fe3+的原因是 (用离子方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。
请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ;
b.沉淀: ;
c.过滤,洗涤;
d.烘干,研磨。
查看答案和解析>>
科目:高中化学 来源:2017届四川省校高三上学期第二次月考化学试卷(解析版) 题型:填空题
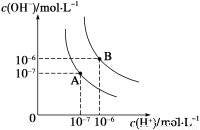
(1)水的电离平衡曲线如图所示,若A点、B点分别表示25 ℃和100 ℃时水的电离达平衡时的离子浓度。则表示25 ℃的是___________(填“A”或“B”)。100 ℃时,在1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=__________mol·L-1。100 ℃时,5×10-5 mol·L-1的H2SO4溶液与pH=9的Ba(OH)2溶液混合后pH=7,则混合前H2SO4溶液与Ba(OH)2溶液的体积比为 。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的NaHCO3溶液、NaCN溶液、Na2CO3溶液、CH3COONa溶液,四种溶液的pH由大到小的顺序为_________________________。
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”)。
③向NaCN溶液中通入少量CO2,所发生反应的离子方程式为_______________________。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl?,利用Ag+与CrO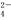 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl?恰好完全沉淀(浓度等于1.0×10?5 mol·L?1)时,溶液中c(Ag+)为___________mol·L?1,此时溶液中c(CrO
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl?恰好完全沉淀(浓度等于1.0×10?5 mol·L?1)时,溶液中c(Ag+)为___________mol·L?1,此时溶液中c(CrO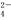 )等于__________ mol·L?1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10?12和2.0×10?10)。
)等于__________ mol·L?1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10?12和2.0×10?10)。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省实验班高三上第一次质检化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.2.0gH218O与D2O的混合物中所含中子数为NA
B.常温常压下,4.4g乙醛所含单键数目为0.7NA
C.标准状况下.5.6 LCO2与足量Na2O2反应转移的电子数为0.5NA
D.50mL1 2mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:选择题
在分析化学中,NH3或其水溶液是一种常用的沉淀剂,用于物质的分离和提纯。已知:NH3•H2O的电离常数K=1.8×10-5,K  sp[Mg(OH)2]=1.8×10-11。向体积为1.0 L、浓度为2.0×10-4 mol·L-1的MgCl2溶液中通入NH3,若不考虑溶液体积变化,当反应开始有白色沉淀出现时,通入NH3的体积(标准状况)为( )
sp[Mg(OH)2]=1.8×10-11。向体积为1.0 L、浓度为2.0×10-4 mol·L-1的MgCl2溶液中通入NH3,若不考虑溶液体积变化,当反应开始有白色沉淀出现时,通入NH3的体积(标准状况)为( )
A.112mL B.224mL C.118.72 mL D.201.6 mL
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:选择题
甲~辛等元素在周期表中的相对位置如下表。甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素。下列判断正确的是( )

A. 乙的单质在空气中燃烧生成只含离子键的化合物
B. 原子半径:庚>辛>戊
C. 金属性:甲>乙>丁
D. 丙和庚的原子核外电子数相差13
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:选择题
东汉魏伯阳在《周易参同契》中对汞的描述:“……得火则飞,不见埃尘,将欲制之,黄芽为根。”这里的“黄芽”是指( )
A.金 B.硫 C.铜 D.铁
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次考试化学卷(解析版) 题型:选择题
已知:葡萄糖的燃烧热是2804.0kJ·mol-1,当它氧化生成1 mol水时,放出的热量
A.26.0kJ B.51.9 kJ C.155.8kJ D.467.3kJ
查看答案和解析>>
科目:高中化学 来源:2017届四川省绵阳市高三上学期第一次月考化学试卷(解析版) 题型:填空题
KMnO4是一种典型的强氧化剂。请回答下列问题:
(1)实验室中可用已知浓度的酸性高锰酸钾溶液滴定含Fe2+的溶液,从而测定溶液中Fe2+的浓度,离子反应方程式如下,请在空格内填上缺少的反应物,并配平:
_______-Fe2++_______MnO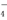 +_______
+_______ ===_______Fe3++_______Mn2++_______H2O
===_______Fe3++_______Mn2++_______H2O
(2)在稀硫酸中,MnO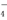 和H2O2也能发生氧化还原反应:
和H2O2也能发生氧化还原反应:
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO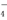 +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
①写出该氧化还原反应的化学方程式:__________________。
反应中若有0.5 mol H2O2参加此反应,转移电子的个数为________。
②实验中发现,当加入的少量KMnO4完全反应后,H2O2仍能发生反应快速放出气体。其可能的原因是__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com