
����Ŀ��������ʾ�����ô������ƴ�����ˮ�еİ�����NH3����ʹ��ת��Ϊ������ȥ������Ҫ��Ӧ���£�
�� NH3��aq��+ HClO��aq���T NH2Cl��aq��+ H2O��l��
�� 2NH2Cl��aq��+ HClO��aq���T N2��g��+ H2O��l��+ 3HCl��aq��
��1���������������������£���һ������ˮ����εμӴ���������Һ������ȥ������n(NaClO)/n(NH3)�ı仯�������£�
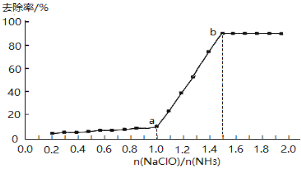
��.����NH2Cl�е�Ԫ�صĻ��ϼ���____________��
��.a-b��䣬��Һ�а���ȥ����Ѹ����ߵ�ԭ����__________��
��2����.��Ӧ�٢���HClO ����Դ�û�ѧ���������__________��
��.ʵ���ã���ˮ��pH�백��ȥ������ͼ��ʾ��
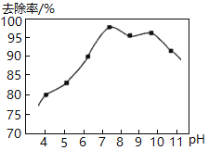
pH�ϸ�ʱ������ȥ�����½���ԭ����__________��
pH�ϵ�ʱ������ȥ����Ҳ�½������ܵ�ԭ����__________��
��3����������ԭ��ȥ����ˮ�еİ������ɽ����ͼ��ʾ�ĵ�ⷨ��
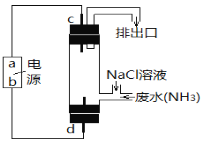
��. a��Ϊ__________��
��. d����ӦʽΪ__________��
���𰸡� -1 c(NaClO)������ˮ��ƽ�������ƶ���ʹc(HClO)������NH3������ΪN2�ٶȼӿ� ClO- + H2O ![]() HClO + OH- pH�ϴ�ʱ��c(OH-)�ϴ�������NaClOˮ����c(HClO)��С��������������ȥ���ʽ��� pH��Сʱ��c(H+)�ϴ����ٽ�NaClOˮ����c(HClO)̫����HClO�ֽ���ȥ���ʽ��� ���� Cl-- 2e- + H2O = H+ + HClO
HClO + OH- pH�ϴ�ʱ��c(OH-)�ϴ�������NaClOˮ����c(HClO)��С��������������ȥ���ʽ��� pH��Сʱ��c(H+)�ϴ����ٽ�NaClOˮ����c(HClO)̫����HClO�ֽ���ȥ���ʽ��� ���� Cl-- 2e- + H2O = H+ + HClO
��������
(1)����HΪ+1�ۣ�ClΪ-1�ۣ����������������ϼ۵ĵ�����Ϊ0����NԪ�صĻ��ϼ�Ϊ0-(+1)��2-(-1)=-1���ʴ�Ϊ��-1��
����a-b��䣬��Һ�а���ȥ����Ѹ����ߵ�ԭ����c(NaClO)����ˮ��ƽ�������ƶ���ʹc(HClO)����NH3������ΪN2�ٶȼӿ죬�ʴ�Ϊ��c(NaClO)����ˮ��ƽ�������ƶ���ʹc(HClO)����NH3������ΪN2�ٶȼӿ죻
(2)��Ӧ�٢���HClO����Դ�û�ѧ���������ClO-+H2OHClO+OH-���ʴ�Ϊ��ClO-+H2OHClO+OH-��
����pH�ϴ�ʱ��c(OH-)�ϴ�����NaClOˮ�⣬c(HClO)��С��������������ȥ���ʽ��ͣ�pH��Сʱ��c(H+)�ϴٽ�NaClOˮ�⣬c(HClO)̫����HClO�ֽ⣬ȥ���ʽ��ͣ��ʴ�Ϊ��pH�ϴ�ʱ��c(OH-)�ϴ�����NaClOˮ�⣬c(HClO)��С��������������ȥ���ʽ��ͣ�pH��Сʱ��c(H+)�ϴٽ�NaClOˮ�⣬c(HClO)̫����HClO�ֽ⣬ȥ���ʽ��ͣ�
(3)��ͼ��֪�����ʱCl-ʧȥ����ת��ΪHClO��HClO�������������ɵ�������d���ӵ�Դ����Ϊ��������֪aΪ������dΪ������������ӦΪCl--2e-+H2O=H++HClO���ʴ�Ϊ��������Cl--2e-+H2O=H++HClO��


 ���ʿ��ÿ��ֳɳ�ϵ�д�
���ʿ��ÿ��ֳɳ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1.52gͭþ�Ͻ���ȫ�ܽ���5mL 14mol/L��Ũ�����У��õ�NO2��N2O4�Ļ������1120 mL ����״��������Ӧ�����Һ�м���1.0 mol/L NaOH��Һ������������ȫ������ʱ���õ�2.54g ����.����˵ ������ȷ����
A. �úϽ���ͭ��þ�����ʵ���֮����2:l
B. �õ�2.54g ����ʱ������NaOH ��Һ�������600mL
C. NO2��N2O4�Ļ�������У�NO2�����������80%
D. ��ͭþ�Ͻ�Ӧ��HNO3�����ʵ���Ϊ0.12mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ǻ�ѧ�о���һ����Ҫ�ֶΣ�������ͼ��ʾA��G���������������Ҫ����ա�
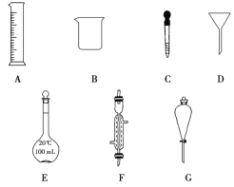
(1)д���������ƣ�D________��E________��
(2)����ʵ��������õ�����G����________(������ѡ��ı����ĸ)��
a������ˮ��CCl4�Ļ����
b������ˮ�;ƾ��Ļ����
c������ˮ����ɳ�Ļ����
(3)ʵ��������100 mL 0.5 mol/L�����ᡣ
�����й�������E��ʹ�÷����У���ȷ����________(������ѡ��ı����ĸ)��
a��ʹ��ǰӦ����Ƿ�©Һ
b��ʹ��ǰ������
c�������������ʷ�Ӧ���ܽ������
d������Һ��ֱ��ת�Ƶ�����
�����Ƹ���Һ����10 mol/L��Ũ����________mL��ȡ�ø��������ʱ����Ҫ�õ����������е�A��________(�������ı����ĸ)��
�����в�����ʹ���Ƶ���ҺŨ��ƫ�ߵ���________(������ѡ��ı����ĸ)��
a.û�н�ϴ��Һת�Ƶ�����ƿ��
b.ת�ƹ�������������Һ����
c.ҡ�Ⱥ�Һ���½�������ˮ
d.����ʱ���ӿ̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���������ʵ��װ���ܴﵽʵ��Ŀ�ĵ���
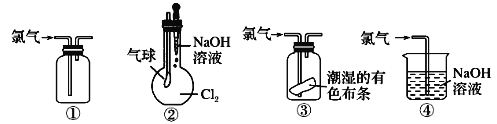
�ٿ������������ռ� ��������ɱ�֤��Cl2����NaOH��Ӧ �ۿ�֤����������Ư���� �ܿ�����ʵ������������β������
A. �٢� B. �٢� C. �ڢ� D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�������X������Y��0.16mol����10L�����ܱ������У�������ӦX(g)+Y(g)![]() 2Z(g)��H<0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±�������˵����ȷ����
2Z(g)��H<0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±�������˵����ȷ����
t/min | 2 | 4 | 7 | 9 |
(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. Ӧǰ2min��ƽ������v(Z)=2.0x10-3mol(L��min)
B. �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv(��)>v(��)
C. ���¶��´˷�Ӧ��ƽ�ⳣ��K=1.44
D. �����������䣬�ٳ���0.2molZ��ƽ��ʱX�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȼҵ�Ե�⾫�Ʊ���ʳ��ˮ�ķ�����ȡ�������������ռ���ȵĺ������ε�ϵ�л�����Ʒ����ͼ�����ӽ���Ĥ�����ʳ��ˮ��ʾ��ͼ��ͼ�е����ӽ���Ĥֻ����������ͨ����
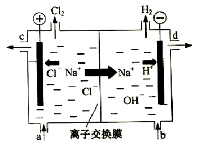
���������գ�
��1��д����ⱥ��ʳ��ˮ�����ӷ���ʽ��
��2�����ӽ���Ĥ������Ϊ�� ��
��
��3�����Ʊ���ʳ��ˮ��ͼ�� λ�ò��䣬����������Һ��ͼ�� λ����������ѡ�a������b������c����d����
��4��KClO3���ԺͲ��ᣨH2C2O4�������ᷴӦ���ɸ�Ч������ɱ����ClO2��������CO2��KHSO4�����ʡ�д���÷�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�к�����Ϊ���뷴Ӧ������ʵ�����������Ϊ�������������ʵ��������з�Ӧ��Ӧ�����ߴ������
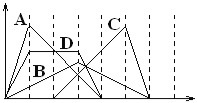
A. ��NaAlO2��Һ�е���HCl������
B. �����ʯ��ˮ��ͨ��CO2������
C. ���������A1C13��Һ�е���NaOH��Һ��������
D. ���е����ʵ�����Ca(OH)2��KOH�Ļ����Һ��ͨ��CO2��������ʧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ī���εĻ�ѧʽΪ( NH4)2Fe(SO4)2��6H2O������ˮ���������Ҵ�����������������ԭ�ζ��Ļ����������ȡĪ���εIJ���װ����ʵ�鲽�裺
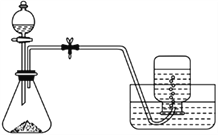
�ٽ���м����С�ձ��У���������Na2CO3��Һ��С����ȼ����ӣ�������Һ��������ˮϴ����м�����ɡ�
������ƿ�м���2.24 g ��м������̼�ۣ��ɷ�Һ©���μ�20 mL 3 mol/L������Һ��
�۴���Ӧ�������ɷ�Һ©������������(NH4)2SO4��Һ�����ˡ�����Һ�м���һ�������Ҵ����������������ˡ�ϴ�ӡ����ɣ���Ī���ξ��塣
��ش��������⣺
��1��ʵ�鿪ʼǰ����鷴Ӧ�������Եķ���Ϊ_____________________��
��2���������Na2CO3��Һ��������_____________________________________��
��3��������еμ�������Һʱ��ȡ������Һ�ڷ�Һ©���е�ԭ����__________________����������̼�۵�������_________________________________________��
��4��������������������2 mol/L ��(NH4)2SO4��Һ______________mL��
��5��ȡ10.00 g����ͭ��Ʒ�������еĸ�����ΪH2CrO4���ټ��������ữ�������250mL��Һ��ȡ��25.00 mL��Ũ��Ϊ0.0180 mol/L��(NH4)2Fe(SO4)2����Һ�ζ����յ�ʱ��ȥ��Һ20.75 mL����֪����H2CrO4����ԭΪCr3+����ζ�ʱ��Ӧ�����ӷ���ʽΪ_____________________________________������Ʒ�и�Ԫ�ص���������Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2(g)+O2(g)=2SO3(g) ��H=-198kJ/mol����V2O5����ʱ���÷�Ӧ�Ļ���Ϊ:V2O5+SO2![]() 2VO2+SO3(��) 4VO2+O2
2VO2+SO3(��) 4VO2+O2![]() 2V2O5(��)
2V2O5(��)
����˵����ȷ����
A. ��Ӧ������Ҫȡ����V2O5������ B. VO2�Ǹ÷�Ӧ�Ĵ���
C. �淴Ӧ�Ļ�ܴ���198kJ/mol D. ����SO2��Ũ�ȿ�������߷�Ӧ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com