
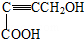 是重要的化工原料,其合成过程如图:
是重要的化工原料,其合成过程如图: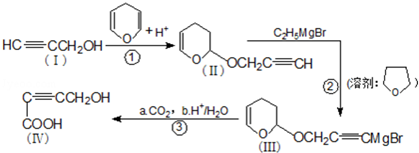
 .
.分析 (1)根据化合物II的结构简式可知其分子式,比较Ⅰ和Ⅱ的结构简式可知,反应①为加成反应;
(2)根据化合物I的结构简式可知其中含氧官能团为羟基,化合物Ⅳ中有碳碳参键,与氢气发生加成反应,据此判断产物名称;
(3)有机物Ⅳ中含有羟基和羧基,可以通过形成酯基而发生缩聚反应生成聚酯;
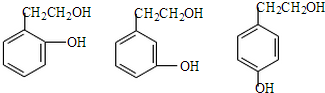
(4)根据条件:无甲基;②能使FeCl3溶液显紫色,说明有酚羟基;③核磁共振氢谱除苯环吸收峰外有四个吸收峰,即有四种位置的氢原子,芳香化合物V说明有苯环,且是II的同分异构体,结合Ⅱ的结构简式书写Ⅴ的结构简式;
(5)A.化合物II中含有一个碳碳双键和一个碳碳参1键,所以1mol化合物II最多能与3molH2发生加成反应;
B.根据化合物II的分子式可知,1mol化合物II燃烧最多消耗9.5molO2;
C.化合物IV中有一个羟基和一个羧基,据此判断;
D.化合物I和IV中都有羟基,在一定条件下都能与乙酸发生酯化反应.
解答 解:(1)根据化合物II的结构简式可知其分子式为C8H10O2,比较Ⅰ和Ⅱ的结构简式可知,反应①为加成反应,
故答案为:C8H10O2; 加成反应;
(2)根据化合物I的结构简式可知其中含氧官能团为羟基,化合物Ⅳ中有碳碳参键,与氢气发生加成反应,生成产物为HOCH2CH2CH2COOH,其名称为1-羟基丁酸,
故答案为:羟基;1-羟基丁酸;
(3)有机物Ⅳ中含有羟基和羧基,可以通过形成酯基而发生缩聚反应生成聚酯,反应方程式为nHOCH2CH2CH2COOH$→_{△}^{浓H_{2}SO_{4}}$(OCH2CH2CH2CO)n+nH2O,
故答案为:nHOCH2CH2CH2COOH$→_{△}^{浓H_{2}SO_{4}}$(OCH2CH2CH2CO)n+nH2O;
(4)根据条件:无甲基;②能使FeCl3溶液显紫色,说明有酚羟基;③核磁共振氢谱除苯环吸收峰外有四个吸收峰,即有四种位置的氢原子,芳香化合物V说明有苯环,且是II的同分异构体,结合Ⅱ的结构简式可知Ⅴ的结构简式为 ,
,
故答案为: ;
;
(5)A.化合物II中含有一个碳碳双键和一个碳碳参1键,所以1mol化合物II最多能与3molH2发生加成反应,故A错误;
B.根据化合物II的分子式可知,1mol化合物II燃烧最多消耗9.5molO2,故B错误;
C.化合物IV中有一个羟基和一个羧基,所以1mol化合物IV能与2mol金属钠、1molNaHCO3反应产生气体,故C正确;
D.化合物I和IV中都有羟基,在一定条件下都能与乙酸发生酯化反应,故D正确,
故选CD.
点评 本题考查有机物推断和性质,为高考高频点,解答本题的关键是根据有机物的转化关系理解反应的过程及熟练掌握有机官能团的性质,难点是同分异构体的书写,同分异构体有官能团异构、官能团位置异构、碳链异构,但要结合限制性条件书写,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 分散质微粒的大小与分散系种类的关系: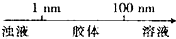 | |
| B. | 常温下溶液的pH其酸碱性的关系: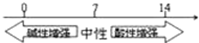 | |
| C. | 硫的化合物中化合价与其氧化性、还原性的关系: | |
| D. | Na与O2反应的产物: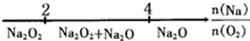 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1表示的烃叫丙烷 | |
| B. | 图2烃分子的结构简式为CH3CH2CH2CH3 | |
| C. | 图1与图2表示的是同一种物质 | |
| D. | 图1与图2表示的物质互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a}^{a+b}$R | C. | ${\;}_{a-m}^{a+b-m}$R | D. | ${\;}_{a+m}^{a+b+m}$R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下0.1 mol/L的下列溶液①NH4Al(SO4)2、②NH4Cl、③NH3•H2O、④CH3COONH4溶液中,c(NH4+)由大到小的顺序是②>①>④>③ | |
| B. | 常温下0.4 mol/L CH3COOH溶液和0.2 mol/L NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度大小顺序为:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 0.1 mol/L(NH4)2Fe(SO4)2溶液:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol/L | |
| D. | 室温下,向0.1 mol/LNH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 整个过程共发生2个氧化还原反应 | |
| B. | 在该溶液中滴少量品红,品红褪色 | |
| C. | 所有离子的浓度都发生了变化 | |
| D. | 反应过程中氯气既作氧化剂又作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑤ | C. | ①②④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com