
答案 (1)1∶3
(2)①2NO2+2NaOH===NaNO3+NaNO2+H2O
②NaNO2
(3)①Na2CO3+2NO2===NaNO3+NaNO2+CO2
②NaNO3:0.05 mol NaNO2:0.15 mol 0.5
解析 (1)设NO的体积为V(NO),NO2的体积为V(NO2),依据方程式知,处理NO需NH3: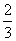 V(NO),处理NO2需NH3:
V(NO),处理NO2需NH3: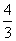 V(NO2),则
V(NO2),则
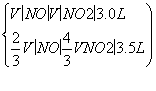
解得V(NO)=0.75 L
V(NO2)=2.25 L
V(NO)∶V(NO2)=1∶3。
(2)①生成两种钠盐,必然是NO2的歧化反应,依据量的关系可知两种盐分别为NaNO3和NaNO2。
②NO中氮的化合价为+2价,NO2中氮的化合物为+4价,二者1∶1混合时与NaOH反应生成一种钠盐,依据电子守恒可知,钠盐中氮的化合价为+3,即为NaNO2。
(3)②n(NO2)=0.15 mol,n(NO)=0.05 mol
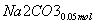 +
+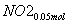 +
+ ===
===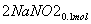 +CO2
+CO2
则单独与Na2CO3反应的NO2为0.15 mol-0.05 mol=0.1 mol
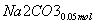 +
+ ===
===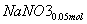 +
+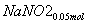 +CO2
+CO2
所以共生成NaNO3:0.05 mol,NaNO2:0.15 mol
c(Na2CO3)= =0.5 mol·L-1。
=0.5 mol·L-1。
★ ★★
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
元素A的各级电离能数据如下:
| I1 | I2 | I3 | I4 | I5 | I6 | |
| I/kJ·mol-1 | 578 | 1 817 | 2 745 | 11 578 | 14 831 | 18 378 |
则元素A的常见价态是( )
A.+1 B.+2 C.+3 D.+6
查看答案和解析>>
科目:高中化学 来源: 题型:
答案 CO 断开CO分子的第一个化学键所需要的能量(273.0 kJ·mol-1)比断开N2分子的第一个化学键所需要的能量(523.3 kJ·mol-1)小
解析 由断开CO分子的第一个化学键所需要的能量[(1 071.9-798.9) kJ·mol-1=273.0 kJ·mol-1]比断开N2分子的第一个化学键所需要的能量[(941.7-418.4) kJ·mol-1=523.3 kJ·mol-1]小,可知CO相对更活泼。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X的最高价氧化物对应的水化物化学式为H2XO3,Y是地壳中含量最高的元素,则XY2由固态变为气态所需克服的微粒间作用力是________;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称______。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是CH4)为原料经合成气(主要成分为CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:_________________________。
(2)与CO互为等电子体的分子和离子分别为________和________(各举一种即可,填化学式),CO分子的电子式为________,CO分子的结构式可表示成________。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有________________,CH3OH的熔、沸点比CH4高,其主要原因是_______________________________________。
(4)CH3CHO分子中,—CH3中的碳原子采取________杂化方式,—CHO中的碳原子采取________杂化方式。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求写出下列反应的离子方程式:
(1)在NH4Cl溶液中加入NaOH溶液,并加热
________________________________________________________________________。
(2)在NH4Cl溶液中滴加NaOH溶液
________________________________________________________________________。
(3)NH4Cl溶液呈酸性的原因
________________________________________________________________________。
(4)在饱和NH4Cl溶液中滴加NaAlO2,产生刺激性气味的气体和白色沉淀
________________________________________________________________________。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
N、O、Si、S是重要的非金属元素,下列说法正确的是( )
A.N、O、S、Si的原子半径逐渐增大,非金属性逐渐减弱
B.氮的氧化物和硫的氧化物既是形成光化学烟雾,又是形成酸雨的主要物质
C.汽车尾气中排放的氮氧化合物主要是由游离态氮转化来的
D.N、Si、S的单质均能和氧气反应,生成的产物分别是NO2、SiO2和SO2
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
用“元素符号”填空(前20号元素)
(1)主族序数与周期数相同的元素有________。
(2)主族序数是周期数2倍的元素有________,3倍的元素有________。
(3)周期数是主族序数2倍的元素有________,3倍的元素有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com