
 2CO2(g)+N2(g)����֪�÷�Ӧ��570Kʱ��ƽ�ⳣ��Ϊ1��1059������Ӧ���ʼ���������˵����ȷ���ǣ�
2CO2(g)+N2(g)����֪�÷�Ӧ��570Kʱ��ƽ�ⳣ��Ϊ1��1059������Ӧ���ʼ���������˵����ȷ���ǣ� | A��װ��β������װ�õ������ų��������в��ٺ���NO��CO |
| B�����β������Ч�ʵ����;����ʹ�ø�Ч���� |
| C������ѹǿ������ƽ�����ƣ���ʵ�ʲ����п�ͨ����ѹ�ķ�ʽ����侻��Ч�� |
| D�����β������Ч�ʵij��÷����������¶� |
 N2(g)+CO2(g)
N2(g)+CO2(g)  H=akJ��mol-1����ij�ܱ���������һ�����Ļ���̿��NO������(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
H=akJ��mol-1����ij�ܱ���������һ�����Ļ���̿��NO������(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�| Ũ��/mol��L-1 ʱ��/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.050 | 0.025 | 0.025 |
| 30 | 0.050 | 0.025 | 0.025 |
| 40 | 0.036 | 0.032 | 0.010 |
| 50 | 0.036 | 0.032 | 0.010 |


 2MgO+SO2+CO2+SO3
2MgO+SO2+CO2+SO3 N2(g)+CO2(g)
N2(g)+CO2(g) 2MgO+SO2+CO2+SO3��
2MgO+SO2+CO2+SO3��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ѧ��Ӧ�е������仯ͨ������Ϊ�����ı仯 |
| B����ѧ���Ķ��Ѻ��γ��ǻ�ѧ��Ӧ�������仯����Ҫԭ�� |
| C����Ӧ��������������������������Դ�С�����˷�Ӧ�Ƿų����������������� |
| D����Ҫ���Ȳ��ܷ����Ļ�ѧ��Ӧһ�������ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����10NA������ת��ʱ���÷�Ӧ�ų�1300kJ������ |
| B����NA��ˮ����������ΪҺ��ʱ������1300kJ������ |
| C����2NA��̼�����õ��Ӷ�����ʱ���ų�1300kJ������ |
| D����8NA��̼�����õ��Ӷ�����ʱ���ų�1300kJ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢� | B���ڢ� | C���٢ܢ� | D���٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| | O=O(g) | H-H(g) | H-O(g) |
| 1mol��ѧ������ʱ��Ҫ���յ�����/kJ | 496 | X | 463 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CH3OCH3(g)+H2O(g) ��H="-25" kJ/mol��ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£���1 L���ܱ������м���CH3OH,��Ӧ��ijʱ�̲�ø���ֵ����ʵ���Ũ�������
CH3OCH3(g)+H2O(g) ��H="-25" kJ/mol��ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£���1 L���ܱ������м���CH3OH,��Ӧ��ijʱ�̲�ø���ֵ����ʵ���Ũ�������| ���� | CH3OH | CH3OCH3 | H2O |
| C/(mo/L) | 0.8 | 1.24 | 1.24 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ϡ������0.1 mol��L��1 NaOH��Һ��Ӧ��H��(aq)��OH��(aq)===H2O(l) ��H����57.3 kJ��mol��1 |
| B���ܱ������У�9.6 g�����11.2 g���ۻ�ϼ�������������17.6 gʱ���ų�19.12 kJ��������Fe(s)��S(s)==="FeS(s)" ��H����95.6 kJ��mol��1 |
| C��������ȼ����Ϊ285.5 kJ��mol��1����ˮ�����Ȼ�ѧ����ʽΪ2H2O(l)===2H2(g)��O2(g) ��H����285.5 kJ��mol��1 |
| D����֪2C(s)��O2(g)==="2CO(g)" ��H����221 kJ��mol��1�����֪C��ȼ����Ϊ110.5 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
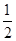 O2(g)=H2O(l) ��H����286 kJ/mol���ж�H2O������O��H���ļ���Ϊ( )
O2(g)=H2O(l) ��H����286 kJ/mol���ж�H2O������O��H���ļ���Ϊ( )| A��485��5 kJ/mol | B��610 kJ/mol |
| C��917 kJ/mol | D��1 220 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 SO2(g)����H=a kJ��mol-1(a=-297.2)����������˵��,���в���ȷ����(����)
SO2(g)����H=a kJ��mol-1(a=-297.2)����������˵��,���в���ȷ����(����)| A��S(s)��O2(g)��ȼ�յķ�Ӧ�Ƿ��ȷ�Ӧ |
B��S(g)+O2(g) SO2(g)����H=b kJ��mol-1,��a>b SO2(g)����H=b kJ��mol-1,��a>b |
| C��1 mol SO2(g)�����е���������1 mol S(s)��1 mol O2(g)�����е�����֮�� |
| D��16 g�������ڿ����г��ȼ��,������148.6 kJ������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com