
| A. | 常温下,0.1 mol•L-1 HA溶液的pH=3,则HA的电离:HA=H++A- | |
| B. | 用铜电极电解饱和硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 向1 mL 2 mol•L-1NaOH溶液中滴加1~2滴0.1 mol•L-1MgCl2溶液后,再滴加2滴0.1 mol•L-1 FeCl3溶液:Mg2++2OH-═Mg(OH)2↓,3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| D. | 钢铁发生吸氧腐蚀生成铁锈:2Fe+O2+2H2O═2Fe(OH)2,4Fe(OH)2+O2+2H2O═4Fe(OH)3,2Fe(OH)3═Fe2O3•xH2O+(3-x)H2O |
分析 A.0.1 mol•L-1 HA溶液的pH=3,说明HA不能完全电离,为弱酸;
B.铜为阳极为活性电极,阳极铜失去电子发生氧化反应;
C.向MgCl2溶液中滴2滴2mol•L-1 NaOH溶液,有Mg(OH)2白色沉淀生成,再滴2滴0.1mol•L-1 FeCl3溶液,静置,氢氧化镁沉淀转化为氢氧化铁沉淀;
D.钢铁发生吸氧腐蚀,铁做负极失去电子生成二价铁离子,阴极氧气得到电子生成氢氧根离子,二者结合生成氢氧化亚铁,氢氧化亚铁不稳定,被空气中氧气氧化生成氢氧化铁,氢氧化铁分解生成带结晶水的铁锈.
解答 解:A.常温下,0.1 mol•L-1 HA溶液的pH=3,说明HA不能完全电离,为弱酸,则HA的电离:HA?H++A-,
故A错误;
B.用铜电极电解饱和硫酸铜溶液,阳极铜失去电子生成铜离子,阴极铜得到电子生成铜,故B错误;
C.向1 mL 2 mol•L-1NaOH溶液中滴加1~2滴0.1 mol•L-1MgCl2溶液后,离子方程式:Mg2++2OH-═Mg(OH)2↓,再滴加2滴0.1 mol•L-1 FeCl3溶液,氢氧化镁沉淀转化为氢氧化铁沉淀,离子方程式3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+,故C正确;
D.钢铁发生吸氧腐蚀生成铁锈,方程式:2Fe+O2+2H2O═2Fe(OH)2,4Fe(OH)2+O2+2H2O═4Fe(OH)3,2Fe(OH)3═Fe2O3•xH2O+(3-x)H2O,故D正确;
故选:CD.
点评 本题考查了离子方程式的书写,明确物质的性质及离子方程式书写方法是解题关键,注意电解池工作原理、沉淀转化规律,题目难度中等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{\;}^{35}$Cl和${\;}_{\;}^{37}$Cl | B. | 金刚石和石墨 | ||
| C. | O2和O3 | D. | CH3CH2OH和CH3OCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4在水溶液中的电离方程式:NaHSO4═Na++HSO4- | |
| B. | H2SO3的电离方程式:H2SO3?2H++SO32- | |
| C. | CaCO3的电离方程式:CaCO3═Ca2++CO32- | |
| D. | CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1 | B. | 0.05mol•L-1 | C. | 0.017mol•L-1 | D. | 0.50mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,4.6g NO2和N2O4混合气体中含有的N原子数目为0.1NA | |
| B. | 25℃时,pH=12的Ba(OH)2溶液中含有的OH-数目为0.01NA | |
| C. | 1L 0.1mol•L-1 K2CO3溶液中,阴离子数目大于0.1NA | |
| D. | 2molSO2和1molO2在密闭容器中加热(V2O5催化)充分反应后,容器内分子总数大于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
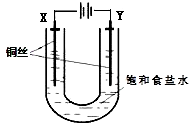 已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )
已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14.如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-═CuCl.下列说法不正确的是( )| A. | Y极发生的电极反应2H2O+2e-═2OH-+H2↑ | |
| B. | 实验开始时,X极附近出现白色浑浊 | |
| C. | 一段时间后,U形管底部形成橙黄色沉淀 | |
| D. | 电解时,Cl-移向Y极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④⑤⑥ | C. | ②④⑥ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Al3+ | B. | Fe3+ | C. | Fe2+、NH4+ | D. | Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活化分子间所发生的碰撞都为有效碰撞 | |
| B. | 合成氨工业中用铁触媒做催化剂能用勒夏特列原理解释 | |
| C. | 升高温度能使化学反应速率增大的主要原因是增加了单位体积内活化分子的百分数 | |
| D. | 将钢闸门与电源的正极相连,是采用了外加电流的阴极保护法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com