
| A、金属铷投入水中会引起爆炸 |
| B、铷是一种强还原剂,铷离子很稳定 |
| C、铷受热后,能在空气中剧烈燃烧,生成比过氧化物更复杂的氧化物 |
| D、铷原子的核电荷数比钾原子的核电荷数多,因此铷原子失电子的能力小于钾原子 |


科目:高中化学 来源: 题型:
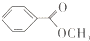 )是一种重要的工业有机溶剂.请分析下列有机物的结构简式或性质特点,然后回答问题.
)是一种重要的工业有机溶剂.请分析下列有机物的结构简式或性质特点,然后回答问题.
| 丙的分子式 | C7H8O |
| 丙的部分性质 | 熔融状态下能与钠反应放出氢气 |
| 遇FeCl3溶液显特殊紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v正(CO)=v逆(H2O) |
| B、体系的压强不再发生变化 |
| C、生成n mol CO的同时生成n mol H2 |
| D、1 mol H-H键断裂的同时断裂2 mol H-O键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子晶体 | B、分子晶体 |
| C、原子晶体 | D、金属晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
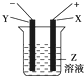 根据如图所示装置回答:
根据如图所示装置回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com