
 ,NaClO3中所含的化学键类型有离子键和共价键.
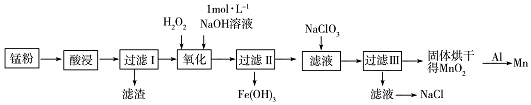
,NaClO3中所含的化学键类型有离子键和共价键.分析 锰粉(含MnO2、Mn(OH)2、Fe和黑炭等)在浓盐酸中浸泡(为除去MnO2可加热),发生MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O、Mn(OH)2+2HCl=MnCl2+2H2O、Fe+2HCl=FeCl2+H2↑等反应,过滤不溶的C,所得滤液中含有Mn2+、Fe2+等离子,在滤液中加入适量过氧化氢和氢氧化钠,可将Fe2+转化为Fe3+,并生成Fe(OH)3,控制溶液pH除去Fe3+,过滤后所得滤液主要为Mn2+,向滤液中加入NaClO3,3Mn2++ClO3-+3H2O=3MnO2↓++6H++Cl-,使Mn2+转化成MnO2,经过滤、洗涤、干燥可得MnO2,再与单质铝发生铝热反应3MnO2+4Al$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3,制得Mn,以此解答该题.
解答 解:(1)过氧化氢为共价化合物,电子式为: ;NaClO3离子化合物,其中所含的化学键类型有为离子键和共价键;
;NaClO3离子化合物,其中所含的化学键类型有为离子键和共价键;
故答案为: ;离子键和共价键;
;离子键和共价键;
(2)对锰粉进行酸浸时所用的酸是浓盐酸,配制NaOH溶液480ml需要的玻璃仪器有烧杯、玻璃棒、胶头滴管、500mL容量瓶、量筒;
故答案为:浓盐酸;胶头滴管、500mL容量瓶、量筒;
(3)已知:K${\;}_{sp(Fe(OH)_{3})}$=1×10-38,常温下,过滤I所得滤液经氧化后,加入NaOH溶液调节pH除去Fe3+,使滤液中的Fe3+沉淀完全,则c(OH-)=$\root{3}{\frac{1×1{0}^{-38}}{1×1{0}^{-5}}}$=10-11,则c(H+)=10-3,pH=3;
故答案为:3;
(4)加入NaClO3目的是将Mn2+氧化为MnO2,发生的离子方程式为:3Mn2++ClO3-+3H2O=3MnO2↓++6H++Cl-;
故答案为:3Mn2++ClO3-+3H2O=3MnO2↓++6H++Cl-;
(5)由Al和MnO2制备Mn的化学方程式为:3MnO2+4Al$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3;
故答案为:3MnO2+4Al$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3;
(6)质量比约为m(Mn):m(Fe)=55:504的合金钢中Mn元素和Fe元素的物质的量之比是1:9,根据原子守恒,投料MnO2、Fe3O4的物质的量之比是1:3,根据铝热反应实质,MnO2~$\frac{4}{3}$Al;Fe3O4~$\frac{8}{3}$Al,1molMnO2和3molFe3O4消耗金属铝共$\frac{28}{3}$mol,所以MnO2、Fe3O4、Al的投料比(按物质的量之比)约为1:3:$\frac{28}{3}$=3:9:28;
故答案为:3:9:28.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、溶度积的计算等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸 | B. | 醋酸 | C. | 稀氨水 | D. | 饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
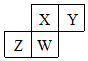 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 元素X、Z的最高化合价分别与其主族序数相等 | |
| C. | 最高价氧化物对应水化物的酸性:Y>X>W | |
| D. | 最简单气态氢化物的热稳定性:Y>X>W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2中所含的中子数为42NA | |
| B. | 9.8g由H2SO4和H3PO4组成的混合物中含有的氧原子数为0.4NA | |
| C. | 2mol•L-1的FeCl3溶液溶液中含有的Fe3+数目小于2NA | |
| D. | 1mol环己烷中含有的共价键数为12NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30gNO和30gSiO2中含有的氧原子数均为NA | |
| B. | 0.5L2.0mol•L-1NaHSO3溶液中含有的HSO3-数目为NA | |
| C. | 标准状况下,5.6LN2与足量的H2反应生成NH3转移的电子数为1.5NA | |
| D. | 标准状况下,11.2LNH3与11.2LHCl混合后所得气体中分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | Mg(OH)2与H2SO4反应:Mg2++2OH-+2H++SO42═MgSO4↓+2H2O | |
| C. | 向硫酸氢钠溶液加氢氧化钡溶液至完全沉淀:H++SO42-+OH-+Ba2+═BaSO4↓+H2O | |
| D. | FeBr2溶液与Cl2按照等物质的量反应:2Br-+Cl2═2Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4(固体) | B. | Na2SO4溶液 | C. | CuSO4(固体) | D. | NaCl(固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| B. | 未使用完的白磷要随时收集起来,并与空气隔绝 | |
| C. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 | |
| D. | 含硫酸的废液倒入水槽,用水冲入下水道 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com