
【题目】五种短周期元素在周期表中的位置如图所示,其中R元素原子的最外层电子数和K层电子数之和等于其次外层电子数,下列判断正确的是
![]()
A. 简单离子的半径大小:Y>Z>R
B. Z的氢氧化物虽然溶解度很小,导电性很差,但它是强电解质
C. Y与X能形成熔点很高的晶体,它是由极性键组成的非极性分子
D. Y与M的最高价氧化物对应的水化物的导电性,Y的不一定比M的强
【答案】D
【解析】
由R元素原子的最外层电子数和K层电子数之和等于其次外层电子数,结合在周期表中的位置可知,R为S,故X为C、Y为N、Z为Al、M为P;
A.N3、Al3+具有相同的离子结构,则核电茶荷数越大,离子半径越小,即离子半径N3>Al3+:;S离子的电子层比N、Al离子的电子层多一层,则离子半径应为S2>N3>Al3+,故A错误;
B.Al(OH)3为两性氢氧化物,难溶于水,属于弱电解质,故B错误;
C.Y与X能形成熔点很高的晶体C3N4,此晶体应为原子晶体,直接由原子构成,不能说分子,故C错误;
D.溶液的导电性与溶液中离子的浓度和所带电荷的多少有关,与强弱电解质无关,故D正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
化学式 | CH3COOH | HClO | H2CO3 |
Ka | 1.8×10﹣5 | 3.0×10﹣8 | Ka1=4.1×10﹣7 Ka2=5.6×10﹣11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B. 向0.1mol·L﹣1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时溶液中c(CH3COOH):c(CH3COO﹣)=9:5
C. 少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D. 等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的氯气通入含Fe2+、I-、Br-的溶液,溶液中四种粒子的物质的量的变化如图所示。已知b=a+5,线段Ⅳ表示一种含氧酸,且线段I和Ⅳ表示的物质中含有相同的元素。下列说法错误的是

A. 线段I表示I-的变化情况
B. a点时消耗Cl2的体积为134.4 L
C. 原溶液中n(Fe2+):n(Br-) =2:3
D. 线段Ⅳ表明氧化性:C12>HIO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是一种银白色的碱土金属,镁元素在地壳中的含量约为2.00%,位居第八位,镁及其化合物在研究和生产中具有广泛用途。请回答下列问题:
(1)氮化镁(Mg3N2)是由氮和镁所组成的无机化合物。在室温下纯净的氮化镁为黄绿色的粉末,能与水反应,常用作触媒,实验室欲用如图1所示装置和药品制备少量氮化镁。

①A中盛装的是浓氨水,B中可盛装___,二者混合可制取氨气。
②按照气流的方向从左至右连接装置:a接___、___接___、___接___。
③已知氨气有还原性,能还原氧化铜,生成物之一是空气的主要成分,该反应的化学方程式为____________________。
④如果没有装有无水氯化钙的装置,可能发生反应的化学方程式为____________________。
(2)碳酸镁可用作耐火材料、锅炉和管道的保温材料,以及食品、药品、化妆品、橡胶、墨水等的添加剂。合成碳酸镁晶须的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完毕,然后用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得到碳酸镁晶须产品(MgCO3·nH2O,n=1~5)。
①配制0.5 mol·L-1 MgSO4溶液500 mL,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、_____。
②步骤3中加氨水后反应的离子方程式为______________。
测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶须,放入图2所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,后期将温度升到30 ℃,最后烧杯中的溶液用已知浓度的盐酸滴定,测得生成CO2的总量;重复上述操作2次。
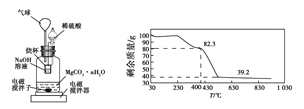
③图中气球的作用是__________________。
④上述反应后期要升温到30 ℃,主要目的是________________。
⑤若实验测得1.000 g碳酸镁晶须产生CO2的平均物质的量为a mol,则n为___(用含a的表达式表示)。
⑥称取100 g上述晶须产品进行热重分析,得到的热重曲线如图所示,则合成的晶须中n=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ksp(AgCl)=1×10-10,Ksp(AgI)=1×10-16,Ksp(Ag2CrO4)=8.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A. AgCl>AgI>Ag2CrO4 B. AgCl>Ag2CrO4>AgI
C. Ag2CrO4>AgCl>AgI D. Ag2CrO4>AgI>AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.10 mol/L标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
实验编号 | NaOH溶液的浓度(mol/L) | 消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 19.98 | 20.00 |
2 | 0.10 | 20.02 | 20.00 |
3 | 0.10 | 20.00 | 20.00 |
(1)滴定时可用的指示剂是__________________。
A.品红溶液 B.酚酞试液 C.石蕊试液
(2)排去碱式滴定管中气泡的方法应采用操作_________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)滴定操作时,眼睛应注视____________________________________________。
(4)滴定达到终点的现象____________________________________________________。
(5)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是_______(填“偏高”或“偏低”或“不影响”,下同);碱式滴定管滴定前仰视滴定后俯视,对测定结果的影响是_______;锥形瓶用水洗净后没用酸润洗,结果会________。
(6)根据上述数据,计算出该盐酸的浓度约为__________________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的有( )
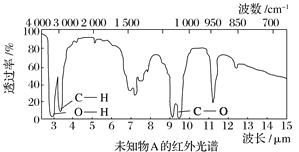
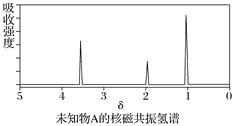
A. 由红外光谱可知,该有机物中至少含有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C. 若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
D. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,书写正确的是( )
A.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.稀硫酸与氢氧化钡溶液反应:Ba2++H++OH-+![]() =H2O+BaSO4↓
=H2O+BaSO4↓
C.在澄清石灰水中通入过量的CO2:Ca2++2OH-+CO2=CaCO3↓+H2O
D.铜片跟硝酸银溶液反应:Cu+2Ag+=Cu2++2Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 在不同的溶剂中可形成不同的分散系:
在不同的溶剂中可形成不同的分散系:![]() 溶解在水中形成无色透明的分散系一;
溶解在水中形成无色透明的分散系一;![]() 溶解在乙醇中形成无色透明的分散系二。下列说法正确的是( )
溶解在乙醇中形成无色透明的分散系二。下列说法正确的是( )
A. 分散系二与雾、霾为同一种类型的分散系
B. 在两个分散系中,![]() 都是以
都是以![]() 和
和![]() 的形式存在
的形式存在
C. 分散系二中,分散质粒子的个数为![]() 个
个
D. 两个分散系都是电解质且性质较稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com