
��15�֣��״���һ�ֿ�������Դ������һ����Ҫ�Ļ���ԭ�ϣ����п�����Ӧ�õĹ���ǰ������ҵ�Ͽ������·����ϳɼ״���
����һ | CO(g) +2H2(g) |
������ | CO2(g) +3H2(g) |
��1����֪���� 2CH3OH(l) + 3O2(g)  2CO2(g) + 4H2O(g) ��H=��1275.6 kJmol-1
2CO2(g) + 4H2O(g) ��H=��1275.6 kJmol-1
�� 2CO(g) + O2(g)  2CO2(g) ��H=��566.0 kJmol-1
2CO2(g) ��H=��566.0 kJmol-1
�� H2O(l) = H2O(g) ��H = + 44.0 kJmol-1
��״�����ȫȼ������CO��Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽΪ ��
��2������һ�����״���Ŀǰ��ҵ�ϳ��õķ�������һ���¶��£���2L�ܱ������г���1molCO��2molH2������������Ӧ��5���ӷ�Ӧ��ƽ�⣬��ʱCO��ת����Ϊ80%����ش��������⣺
��ǰ5�����ڼ״���ƽ����Ӧ����Ϊ ����֪�÷�Ӧ�ڵ��������Է����У���Ӧ��
��HΪ ����������������� ��=����0��
���ڸ��¶��·�Ӧ��ƽ�ⳣ��K= ��
��ijʱ�����ƽ����ϵ�м���CO��H2��CH3OH��0.2mol��ʹ���� ���棨�>����=����<������
��3��ȫ��Һ�����ܵ�������ò�ͬ��̬���ӶԵ�������ԭ��Ӧ��ʵ�ֻ�ѧ�ܺ͵����ת����װ�ã���ԭ������ͼ��ʾ��
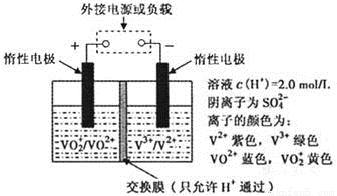
�ٵ������Һ���ɻƱ�������缫��ӦʽΪ ��
�ڳ������У��Ҳ���Һ��ɫ�仯�� ��
�����ü״�ȼ�ϵ����Ϊ��Դ������ʱ�������ļ״�4.8gʱ����·��ת�Ƶĵ�����Ϊ �������ڳ���F=9.65��l04C �� mol-1)��
��1��CH3OH(l) + O2(g)��CO(g) + 2H2O(l) ��H����442.8kJmol-1 ��2�֣�
��2����0.08mol/(Lmin) ��2�֣� ����2�֣� ��100��2�֣� �� ����2�֣�
��3����VO2����e����2H����VO2����H2O ��2�֣�
������ɫ��Ϊ��ɫ��1�֣� ��8.685��104C��2�֣�
��������
�����������1����֪���� 2CH3OH(l) + 3O2(g) 2CO2(g) + 4H2O(g) ��H����1275.6 kJmol-1���� 2CO(g) + O2(g)
2CO2(g) + 4H2O(g) ��H����1275.6 kJmol-1���� 2CO(g) + O2(g) 2CO2(g) ��H����566.0 kJmol-1����H2O(l)��H2O(g) ��H = + 44.0 kJmol-1������ݸ�˹���ɿ�֪���١��ڡ��ۡ�4����2���õ��״�����ȫȼ������CO��Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽCH3OH(l) + O2(g)��CO(g) + 2H2O(l) ��H����442.8kJmol-1��
2CO2(g) ��H����566.0 kJmol-1����H2O(l)��H2O(g) ��H = + 44.0 kJmol-1������ݸ�˹���ɿ�֪���١��ڡ��ۡ�4����2���õ��״�����ȫȼ������CO��Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽCH3OH(l) + O2(g)��CO(g) + 2H2O(l) ��H����442.8kJmol-1��
��2����5���ӷ�Ӧ��ƽ�⣬��ʱCO��ת����Ϊ80%��������CO��0.8mol�����ݷ���ʽCO(g) +2H2(g) CH3OH(g)��֪���ɼ״���0.8mol��Ũ����0.4mol/L�����ǰ5�����ڼ״���ƽ����Ӧ����Ϊ0.4mol/L��5min��0.08mol/(Lmin)����֪�÷�Ӧ�ڵ��������Է����У���������Ӧ�������С�ģ�����S��0������ݡ�G����H��T����S��֪���÷�ӦΪ���ȷ�Ӧ������H��0��
CH3OH(g)��֪���ɼ״���0.8mol��Ũ����0.4mol/L�����ǰ5�����ڼ״���ƽ����Ӧ����Ϊ0.4mol/L��5min��0.08mol/(Lmin)����֪�÷�Ӧ�ڵ��������Է����У���������Ӧ�������С�ģ�����S��0������ݡ�G����H��T����S��֪���÷�ӦΪ���ȷ�Ӧ������H��0��
������CO��0.8mol����ƽ��ʱ������CO�����ʵ����ֱ���0.4mol��0.2mol��Ũ�ȷֱ���0.2mol/L��0.1mol/L����ѧƽ�ⳣ������һ�������£������淴Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ�����ڸ��¶��·�Ӧ��ƽ�ⳣ��K��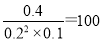 ��
��
��ijʱ�����ƽ����ϵ�м���CO��H2��CH3OH��0.2mol��˲��CO�������ͼ״���Ũ�ȷֱ��Ϊ0.2mol/L��0.3mol/L��0.5mol/L�����ʱŨ���̣�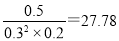 ��100�����ƽ��������Ӧ������У����Խ�ʹ���������档
��100�����ƽ��������Ӧ������У����Խ�ʹ���������档
��3���ٵ������Һ���ɻƱ�����˵��VO2��ת��ΪVO2������VԪ�صĻ��ϼ۴�+3�����ߵ�+4�ۣ�����缫��ӦʽΪVO2����e����2H����VO2����H2O��
�ڳ������У��Ҳ��е缫���Դ����������������V3���õ�����ת��ΪV2���������Һ��ɫ�仯������ɫ��Ϊ��ɫ��
��4.8g�״������ʵ�����4.8g��32g/mol��0.15mol���ڷ�Ӧ��ʧȥ0.15mol��6��0.9mol���ӣ����Ե�·��ת�Ƶĵ�����Ϊ9.65��l04C��mol-1��0.9mol��8.685��104C��
���㣺�����˹���ɵ�Ӧ�á�ƽ��״̬���㡢��Ӧ�Է����Լ��绯ѧԭ����Ӧ��


 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015�����ɽ�ظ�һ��ѧ����ĩ������⻯ѧ�Ծ��������棩 ���ͣ������
��6�֣���ֱ�ѡ��һ���Լ���ȥ���������е����ʣ���д����Ӧ�����ӷ���ʽ��
���� | ���� | ��ѡ�Լ� | ���ӷ���ʽ | |
�� | NaCl��Һ | Na2CO3 | ||
�� | Mg�� | Al�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ����и߶���ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
ijѧ����ʵ�鱨�����г������������к�������
A.��10mL��Ͳ��ȡ7.13mLϡ����
B.��������ƽ����25.20g NaCl
C.�ù㷺pH��ֽ���ij��Һ��pHΪ2.3
D.��25mL�ζ������к͵ζ�ʱ����ȥijŨ�ȵļ���Һ21.70mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ������УЭ���������ѧ����ĩ�������ۻ�ѧ�Ծ��������棩 ���ͣ������
(15��)ijͬѧ��̽���ϸɵ���ڵĺ�ɫ�����������ʱ��������ͼʾʵ�飺

���Ľ̲Ŀ�֪����ͨп�̵�صĺ�ɫ������Ҫ�ɷ�ΪMnO2��NH4Cl��ZnCl2�����ʡ���ش��������⣺
��1����������������ʱ������Ҫ�����оƾ��ơ��������� �� �� ��
��2�������ܵ��Թܼ���������ú�ɫ�������Թ���Ѹ�ٲ�����ʹ�����ǵ�ľ����ȼ�����壬�ݴ˿ɳ����϶���ɫ����Ϊ ��
��3�����������������еĺ�ɫ����ʱ������һ��ʹ����ʯ��ˮ����ǵ����壬�ɴ��Ʋ������л����ڵ�����Ϊ ��
��4����ͬѧҪ����Һ�ijɷֽ��м��飬��ȷ���Ƿ���NH4Cl��ZnCl2��
������������ʵ�����д��ʵ�鱨�棬����д����հ״������ݣ�
ʵ��Ŀ�� | ���� | ʵ������ | ���� |
1������Cl�� | ȡ������Һ���Թ��У� , | , | ����Cl�� |
2������NH4+ | ȡ������Һ���Թ��У� , | , | ����NH4+ |
3������Zn2+ | ȡ������Һ���Թ��У����� ϡ��ˮ | �Ȳ�����ɫ�������������백ˮ���������ܽ� | ����Zn2+ |
��5���������ϵ�ʵ�鱨�棬������Һ�ijɷ֣���Ľ����ǣ� ��ͨ��һ���IJ�������Һ�еõ��������ʣ� ��Ҫ�����ù��������е����ʼ��Է��룬���� ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ������ʡ������УЭ���������ѧ����ĩ�������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ�����ӵ�������ֵ�����������в���ȷ����
A��16.9 g��������(BaO2)��������������������ԼΪ0.2NA
B�����³�ѹ�£�28 g��ϩ�ͻ�����(C4H8)�Ļ�������к��е�̼ԭ����Ϊ2NA
C����״���£�0��1molCl2����ˮ��ת�Ƶĵ�����ĿС��0��1NA
D��ij�ܱ�����ʢ��0.1 mol N2��0.3 mol H2����һ�������³�ַ�Ӧ��ת�Ƶ��ӵ���ĿΪ0.6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ�������и����ڶ����ʼ����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�־ۺ�������ӵ�طŵ�ʱ�ķ�ӦΪLi1��xCoO2��LixC6===6C��LiCoO2��������ͼ��ʾ������˵������ȷ����

A���ŵ�ʱ��LixC6����������Ӧ
B�����ʱ��Li��ͨ�������ӽ���Ĥ���������ƶ�
C�����ʱ����صĸ�������ӵ�Դ�ĸ������������ӽ���Ĥ
D���ŵ�ʱ����ص�������ӦΪLi1��xCoO2��xLi����xe��===LiCoO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ���и�����һѧ����ĩ���в��Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
��16�֣��̷���FeSO4��7H2O��������ȱ����ƶѪҩƷ����Ҫ�ɷ֡���������������м�����������������������ʣ�Ϊԭ�����������̷���һ�ַ�����

��֪�������±���H2S��Һ��pHԼΪ3.9��SnS������ȫʱ��Һ��pHΪ1.6��FeS��ʼ����ʱ��Һ��pHΪ3.0��������ȫʱ��pHΪ5.5��
��1��ͨ������������ǣ�
�ٳ�ȥ��Һ�е�Sn2+����
�ڳ�ȥ��Һ�е�Fe3+���䷴Ӧ�����ӷ���ʽΪ ������II������Һ���������ữ��pH��2��Ŀ���� ��
��2������IV��˳������Ϊ�� �� �����ˡ�ϴ�ӡ����
��3������IV�õ����̷�������������ˮϴ�ӣ���Ŀ���ǣ�
�ٳ�ȥ������渽�ŵ���������ʣ�
�� ��
��4���ⶨ�̷���Ʒ��Fe2+�����ķ����ǣ�
a.��ȡһ�������̷���Ʒ�����Ƴ�250.00mL��Һ��
b.��ȡ25.00mL������Һ����ƿ�У�
c.�������ữ��0.01000 mol/LKMnO4��Һ�ζ����յ㣬����KMnO4��Һ�����ƽ��ֵΪ20.00mL���ζ�ʱ������Ӧ�����ӷ���ʽΪ��5Fe2+��MnO4����8H+=5Fe3+��Mn2+��4H2O����
���������ữ��0.01000 mol/LKMnO4��Һ�ζ�ʱ�����ְ�����ʽ�ζ��ܵĻ���������ҡ����ƿ���۾�ע�� ��
���жϴ˵ζ�ʵ��ﵽ�յ�ķ����� ��
���������������ⶨ����Ʒ��FeSO4��7H2O����������ƫ�ͣ��ⶨ�����в��������ɺ��ԣ��������ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ���и�����һѧ����ĩ���в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йػ�ѧ����ı�ʾ��ȷ����
A��������Ϊ37����ԭ�ӣ�
B��������̼���ӵı���ģ�ͣ�

C�� NH4Br�ĵ���ʽ��
D�����ǻ�����ȩ�Ľṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����в������и�����ѧ����ĩͳ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʱ��������Һ��pH���������ʵ���Ũ�ȹ�ϵ��ȷ����
A��ij��Һ����ˮ�������c��H������1��10��a mol/L����a��7ʱ������ҺpHһ��Ϊ14��a
B��0.1mol/L��KHA��Һ����pH��10��c(K+)��c(A2-)��c(HA-) ��c(OH-)
C����0.2 mol/L��ijһԪ��HA��Һ��0��1 mol/L NaOH��Һ�������Ϻ���ҺpH����7����Ӧ��Ļ��Һ�� c(HA)>C(Na��)>c(A��)
D��������������ʵ���Ũ�ȵ�Na2CO3��Һ��NaHCO3��Һ��ϣ�3c��Na������2c��CO32������2c��HCO3������2c��H2CO3��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com