
 硫酸和纯碱都属于工业上常用的“三酸两碱”.回答下列问题:
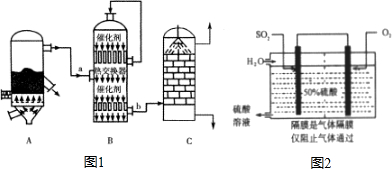
硫酸和纯碱都属于工业上常用的“三酸两碱”.回答下列问题:分析 Ⅰ(1)依据接触法制硫酸的工业流程和设备反应分析:A设备是硫铁矿与氧气在高温下的煅烧反应,在沸腾炉中进行.
(2)A.依据三氧化硫吸收的方法是利用浓硫酸吸收,防止形成酸雾,阻止吸收分析判断;
B.根据S元素守恒,利用关系式计算;
C.二氧化硫生成三氧化硫的反应是放热的可逆反应,运用平衡移动的原理判断;
D.硫酸工业中在接触室安装热交换器是为了利用二氧化硫生成三氧化硫的反应是放热.
(3)利用原电池原理制硫酸溶液,通O2的极为正极,电极反应为O2+4e-+4H+=2H2O,通SO2的极为了负极,电极反应为2SO2-4e-+4H2O=2SO42-+8H+,结合正负极得失电子是相等的,即得原电池反应2SO2+O2+2H2O=2H2SO4,根据稀硫酸溶液的质量分数是50%,假设溶液里硫酸的质量为98g,据此可计算出通入SO2的质量和水的质量比.
Ⅱ(1)氨碱法:以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱,工艺中产生大量CaCl2的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O.
(2)联合制碱法:以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱,联合制碱法的原理为:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl; 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(3)联合制碱法中CO2来源于氨工业的废气,氨碱法中CO2的来源于石灰石煅烧.
解答 解:(1)A设备是硫铁矿与氧气在高温下煅烧反应在沸腾炉中进行,方程式为4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2
故答案为:沸腾炉;4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2FeO3+8SO2.
(2)a.设备C中用98.3%的H2SO4来吸收SO3的原因是,用水吸收易形成酸雾阻止三氧化硫的吸收,故a正确;
b.根据S元素守恒,利用关系式可看出.
设黄铁矿m克,含硫为48%m克,含FeS2为$\frac{120}{64}$×48%m克,据比例关系:
FeS2------------------2S
$\frac{120}{64}$×48%m×(1-2%) 48%m×98%
则S损失为:$\frac{48%m-48%m×98%}{48%m}$×100%=2%故b正确;
c.二氧化硫生成三氧化硫的反应是放热的可逆反应,升高温度平衡向吸热方向移动,降低SO2的转化率,故c错误;
d.硫酸工业中在接触室安装热交换器是为了利用二氧化硫生成三氧化硫的反应是放热,而不是利用SO3转化为H2SO4时放的热量,故d错误;
故答案为:cd;
(3)利用原电池氧化SO2制硫酸的总反应式2SO2+O2+2H2O=2H2SO4,根据稀硫酸溶液的质量分数是50%,假设溶液里硫酸的质量为98g,溶液里水的质量也为98g,生成的硫酸的物质的量为=1mol,结合原电池反应式可知参加反应的SO2和H2O的物质的量也为1mol,则SO2的质量为1mol×64g/mol=64g,水的质量为1mol×18g/mol=18g,通入通入SO2的质量和水的质量比为=16﹕29,故答案为:16﹕29;
Ⅱ(1)氨碱法工艺中产生大量CaCl2是由氯化铵和消石灰在加热条件下反应后生成氨气和氯化钙的反应,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
(2)联合制碱法是在氨的饱和NaCl溶液中二氧化碳气体,反应生成碳酸氢钠,解热碳酸氢钠即可制备碳酸钠,反应的有关方程式为,NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl;2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl;2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(3)CO2是制碱工业的重要原料,联合制碱法中CO2来源于合成氨工业的废气,氨碱法中CO2的来源于石灰石煅烧,
故答案为:合成氨厂;煅烧石灰石.
点评 考查硫酸的工业制法,氨碱法(索氏)和联合制碱法(侯氏)的原理,涉及化学平衡的移动,原电池原理,原子守恒在化学计算中的应用,反应条件的选择等,掌握原理是解题的关键,对学生基础要求较高,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | △H>0表示放热反应,△H>0表示吸热反应 | |
| B. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 | |
| C. | 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热量叫做中和热 | |
| D. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
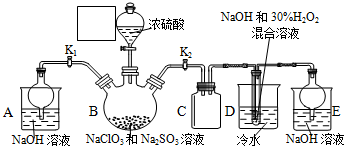
 (1)配置混合溶液时,加入试剂的正确顺序是A(填“A”或“B”);
(1)配置混合溶液时,加入试剂的正确顺序是A(填“A”或“B”);查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 己二酸
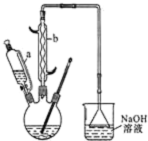
己二酸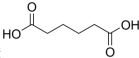 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 己二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇,不溶于苯 | 146 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/(g•cm-3) | 0.789 3 | 1.460 4 | 0.809 8 | 1.275 8 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
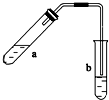 可用图示装置制取少量乙酸乙酯(部分图中均已略去).请填空:
可用图示装置制取少量乙酸乙酯(部分图中均已略去).请填空:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
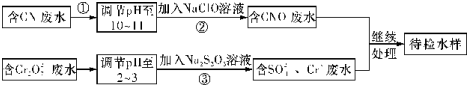
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类是具有甜味的物质 | |
| B. | 糖类是人体必需的营养素 | |
| C. | 葡萄糖是一种多羟基醛,不具有还原性 | |
| D. | 糖类是具有Cn(H2O)m通式的物质,糖也称为碳水化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com