
| A. | 冰-混合物 | B. | 纯碱-盐 | ||
| C. | 澄清石灰水-纯净物 | D. | 洁净的空气-纯净物 |
科目:高中化学 来源: 题型:解答题
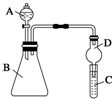 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与乙醇反应不如与水反应活泼,体现了羟基对乙基的影响 | |
| B. | 在溴乙烷分子中,溴原子与乙基之间的影响是相互的 | |
| C. | 苯酚比苯更容易发生苯环上的取代反应,体现了羟基对苯基的影响 | |
| D. | 苯酚与溴水作用可得三溴苯酚,而苯与纯溴作用,要在催化剂作用下才只得到一溴代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | W |
| A. | 原子半径:Z>X>Y | |
| B. | Y的最高正价与最低负价的和是4 | |
| C. | W的单质是工业制取盐酸的原料之一 | |
| D. | X、W的氢化物相遇会产生白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 密度(20℃) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| A | 0.7137g/mL | -116.6 | 34.5 | 不溶于水 |
| B | 0.7893g/mL | -117.3 | 78.5 | 与水以任意比混溶 |
| A. | 蒸馏 | B. | 过滤 | ||
| C. | 萃取 | D. | 加水充分振荡,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
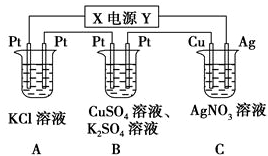
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期中非金属性最强的元素位于本周期最右边 | |
| B. | 原子序数为15的元素的最高化合价为+3 | |
| C. | 原子序数为38的元素位于元素周期表的第五周期,第ⅡA族 | |
| D. | 第二周期,第ⅣA族元素的原子核电荷数和中子数一定为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
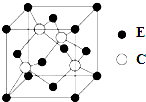 A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.回答下列问题:
A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
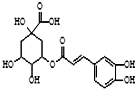 金银花的有效成分为绿原酸,具有广泛的杀菌、消炎功能,其结构简式如图.
金银花的有效成分为绿原酸,具有广泛的杀菌、消炎功能,其结构简式如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com