
分析 密度之比等于相等分子质量之比,计算有机物相对分子质量,再计算有机物、二氧化碳的物质的量,根据原子守恒计算有机物分子中C、H原子数目,结合相对分子质量计算O原子数目,进而确定有机物分子式.
解答 解:有机物相对分子质量为29×2.07=60,
1.5g 有机物的物质的量为$\frac{1.5g}{60g/mol}$=0.025mol,
燃烧生成0.1mol水,生成二氧化碳为$\frac{1.68L}{22.4L/mol}$=0.075mol,
故有机物分子中N(C)=$\frac{0.075mol}{0.025mol}$=3、N(H)=$\frac{0.1mol×2}{0.025mol}$=8,则N(O)=$\frac{60-12×3-8}{16}$=1,
则有机物分子式为C3H8O,
答:该有机物分子式为C3H8O.
点评 本题考查有机物分子式有关确定,掌握燃烧法利用原子守恒确定有机物分子式,旨在考查学生对基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 单质有还原性 | B. | 硒元素在化合物中可显-2价 | ||
| C. | 硒化氢水溶液显弱碱性 | D. | 最高价氧化物的水化物显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 炭粉 | 一氧化碳 | 氢气 | 甲烷 | 乙醇 |
| 状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
| 热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1367 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
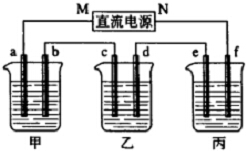 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放硫酸铜溶液、饱和氯化钠溶液(滴有少许酚酞)和100g10.00%的Na2SO4溶液.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放硫酸铜溶液、饱和氯化钠溶液(滴有少许酚酞)和100g10.00%的Na2SO4溶液.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
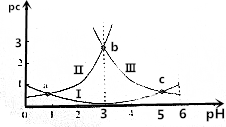
| A. | 曲线Ⅰ表示H2C2O4的变化 | |
| B. | pH=4时,c(HC2O4-)>c(C2O42-) | |
| C. | c(H2C2O4)+c(HC2O4-)+c(C2O42-)在a点和b点一定相等 | |
| D. | 常温下,$\frac{c({H}_{2}{C}_{2}{O}_{4})•c({C}_{2}{{O}_{4}}^{2-})}{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}$随pH的升高先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2和Na2O2 | B. | NaOH和CCl4 | C. | CO2和MgCl2 | D. | NaOH和NaClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
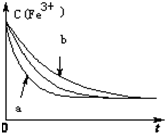 已知下列反应:
已知下列反应:| cm(I-)(mol/L)m | cn(Fe3+)[(mol/L)n] | v[mol/(L•s)] | |
| a | 0.20 | 0.80 | 0.032 |
| b | 0.60 | 0.40 | 0.144 |
| c | 0.80 | 0.20 | 0.128 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 葡萄糖和蔗糖 | B. | 蔗糖和麦芽糖 | ||
| C. | 甲酸甲酯(HCOOCH3)和乙酸(CH3COOH) | D. | 淀粉和纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com