
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)。
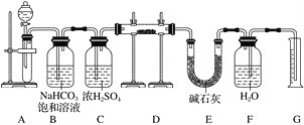
回答下列问题:
(1)装置A中液体试剂选用________________。
(2)装置B的作用是_________。装置E中碱石灰的作用是________。
(3)装置D中发生反应的化学方程式是__________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为_____。
【答案】6 mol·L-1盐酸 除去气体中的HCl 吸收装置D中反应剩余的CO2,防止水蒸气进入D中干扰实验 2Na2O2+2CO2=2Na2CO3+O2、Na2O+CO2=Na2CO3 78%
【解析】
装置A中盐酸与CaCO3固体制得二氧化碳,因盐酸具有挥发性,二氧化碳中混有氯化氢和水蒸气,装置B中饱和碳酸氢钠溶液除去氯化氢,装置C中浓硫酸干燥二氧化碳除去水蒸气,装置D为二氧化碳和过氧化钠和氧化钠反应的装置,装置E中碱石灰吸收过量的二氧化碳,防止水蒸气进入D中干扰实验,装置F和G为量气装置,测定反应生成氧气的体积。
(1)碳酸钙和硫酸反应时,生成的硫酸钙是微溶于水的,会覆盖在碳酸钙的表面,使反应不能持续,所以用盐酸而不用硫酸来反应,故答案为:6 mol·L-1盐酸;
(2)碳酸钙和盐酸反应生成的二氧化碳气体中含有氯化氢气体,用饱和碳酸氢钠溶液来除去;装置E中碱石灰的作用是吸收未反应的二氧化碳,防止对氧气的体积测量造成干扰,故答案为:除去气体中的HCl;吸收装置D中反应剩余的CO2,防止水蒸气进入D中干扰实验;
(3)装置D含有氧化钠和过氧化钠,均会和二氧化碳反应,氧化钠与二氧化碳反应生成碳酸钠,反应的化学方程式为Na2O+CO2=Na2CO3,过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2、Na2O+CO2=Na2CO3;
(4) 标准状况下224 mL氧气的物质的量为0.01mol,由反应2Na2O2+2CO2=2Na2CO3+O2可计知过氧化钠的物质的量为0.02 mol,则过氧化钠的纯度为![]() ×100%=78%,故答案为:78%。
×100%=78%,故答案为:78%。


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】几种晶体的晶胞如图所示:
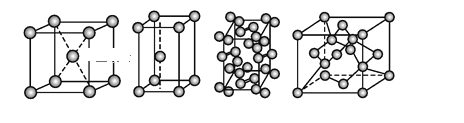
所示晶胞从左到右分别表示的物质正确的排序是
A. 碘、锌、钠、金刚石B. 金刚石、锌、碘、钠
C. 钠、锌、碘、金刚石D. 锌、钠、碘、金刚石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造羊毛的主要成分为![]() ,此物质可由以下三种途径合成,已知A是石油分馏的一种产品,A均裂可生成等物质的量的C2H4和C2H6。
,此物质可由以下三种途径合成,已知A是石油分馏的一种产品,A均裂可生成等物质的量的C2H4和C2H6。
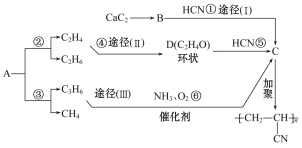
回答下列问题:
(1)写出A的分子式______,D的结构式______。
(2)在反应①~⑥中,属于加成反应的是________。
(3)写出反应⑥的化学反应方程式:____________。
(4)从能源和环保的角度看,你认为最有发展前景的是_____,其中的理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列结构图中,●代表前二周期元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键。示例:(图中F2)根据各图表示的结构特点,下列有关叙述正确的是( )

A. 上述结构图中共出现6种元素 B. 甲、乙、丙为非极性分子,丁为极性分子
C. 甲与丁可以发生化合反应生成离子化合物 D. 向CaCl2溶液中通入丙有白色沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种剧毒气体,对H2S废气资源化利用的途径之一是回收能量并得到单质硫。如图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
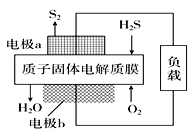
A. 电极a发生还原反应
B. 当电路中通过4 mol电子时,有4molH+经质子膜进入负极区
C. 电池总反应为:2H2S+3O2 =2SO2+2H2O
D. 电极b的电极反应式为:O2+4e-+4H+=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的NaOH溶液与CH3COONa溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
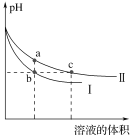
A. c点的溶液中c(OH)+c(CH3COOH)=c(H+)
B. a、b两点溶液的导电性:a>b
C. b、c两点溶液中水的电离程度:b=c
D. 用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸的体积:Vb=Vc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是
A.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO![]() + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
B.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有2.32 g白色沉淀,在所得的浊液中逐滴加入1 mol·L1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如下图所示,试回答:
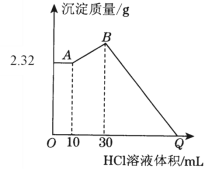
(1)B点的沉淀物的化学式为__________;写出A→B段发生反应的化学方程式_____________________________。
(2)原混合物中MgCl2的质量是________g,AlCl3的质量是________g。
(3)Q点HCl溶液加入量是________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按所给的要求,回答下列问题:
(1)BC13和NC13中心原子的杂化方式分别为______和____。第一电离能介于B、N之间的第二周期元素有______种。
(2)F-、K+和Fe3+三种离子组成的化合物K3FeF6,其中化学键的类型有______;该化合物中存在一个复杂的离子该离子的化学式为______,作配位体的原子是______;
(3)HCHO分子中既含σ 键又含π键______(填“正确”或“错误”) 。
(4)下列物质变化,只与范德华力有关的是(______)
A 干冰升华 B 乙醇汽化 C 乙醇与丙酮混溶 D 氯化钠溶于水 E 碘溶于四氯化碳 F 石英熔融
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com