
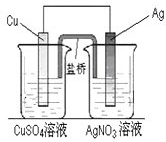
| A.①② | B.①②④ | C.①②③ | D.①②③④ |
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源:不详 题型:单选题
| A.电池工作时,CO2—3向负极移动 |
| B.电池放电时,外电路电子由通氧气的正极流向通氢气的负极 |
| C.正极的电极反应为:4OH—→O2↑+2H2O+2e— |
| D.通氧气的电极为阳极,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.利用电池外壳的金属材料 |
| B.回收其中的石墨电极 |
| C.防止电池中的汞、镉和铅等重金属离子对土壤和水的污染 |
| D.不使电池中渗泄的电解液腐蚀其它物品 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通入H2的电极为正极 |
| B.正极的电极反应式为O2+2H2O+4e-=4OH- |
| C.工作时,负极区溶液pH增大 |
| D.工作时,溶液中的阴离子移向正极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
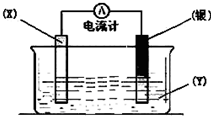
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
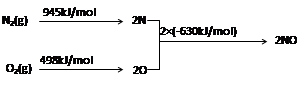
 2NO(g) △H= 。
2NO(g) △H= 。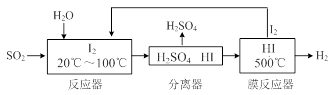
 NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
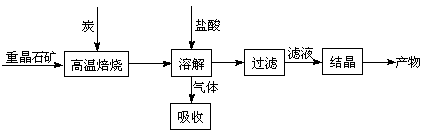
 4CO(g) + BaS(s) △H1 =+571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 =+571.2 kJ·mol-1 ① 2CO2(g) + BaS(s) △H2=+226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2=+226.2 kJ·mol-1 ② = 。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
= 。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10] 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2CH3OH(g) △H= 37Kj·mol-1
2CH3OH(g) △H= 37Kj·mol-1 3 H2(g)+CO2(g) △H =49Kj·mol-1
3 H2(g)+CO2(g) △H =49Kj·mol-1 CO(g) +H2O(g) △H=41.3Kj·mol-1
CO(g) +H2O(g) △H=41.3Kj·mol-1 CH3OH(g) △H <0。现将l0mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(
CH3OH(g) △H <0。现将l0mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(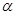 )与温度、压强的关系如下图所示。
)与温度、压强的关系如下图所示。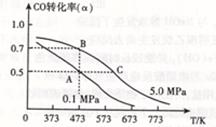
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com