
| A. | MnS的Ksp比CuS的Ksp小 | |
| B. | 该反应达平衡时c(Mn2+)=c(Cu2+) | |
| C. | 设该反应的平衡常数为K,则该关系成立:K×Ksp(CuS)=Ksp(MnS) | |
| D. | 往平衡体系中加入少量CuSO4固体后,c(Cu2+)减小,c(Mn2+)变大 |
分析 A.发生沉淀的转化,向溶度积更小的方向移动;
B.平衡时,浓度不变;
C.K=$\frac{c(M{n}^{2+})}{c(C{u}^{2+})}$;
D.加入少量CuSO4固体后,c(Cu2+)增大,平衡正向移动.
解答 解:A.发生沉淀的转化,向溶度积更小的方向移动,则MnS的Ksp比CuS的Ksp大,故A错误;
B.平衡时,浓度不变,不一定相等,是否相等与起始浓度、转化率有关,故B错误;
C.K=$\frac{c(M{n}^{2+})}{c(C{u}^{2+})}$=$\frac{c(M{n}^{2+})c({S}^{2-})}{c(C{u}^{2+})c({S}^{2-})}$=$\frac{Ksp(MnS)}{Ksp(CuS)}$,则K×Ksp(CuS)=Ksp(MnS),故C正确;
D.加入少量CuSO4固体后,c(Cu2+)增大,平衡正向移动,则c(Mn2+)变大,故D错误;
故选C.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握沉淀的转化,K与Ksp的关系、平衡移动为解答的关键,侧重分析与应用能力的考查,选项B为易错点,题目难度不大.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图都是简化的碳架结构:
如图都是简化的碳架结构:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
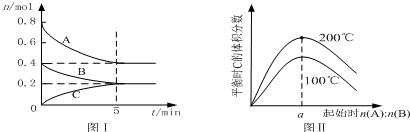
| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| B. | 图Ⅱ所知反应xA(g)+yB(g)?zC(g)的△H<0,且a=2 | |
| C. | 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) | |
| D. | 200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
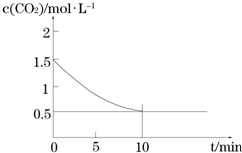
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com