
| ||
| △ |
| ||
| △ |


科目:高中化学 来源: 题型:
| A、阿伏加德罗常数 |
| B、摩尔质量 |
| C、一定质量气体的体积 |
| D、O2的相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量二氧化碳通人偏铝酸钠溶液中:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32- | ||||
| B、氯化铝溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O | ||||
| C、在碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ | ||||
D、碳酸氢铵溶液与过量的NaOH溶液混合:NH4++HCO3-+2OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.8molNa2CO3和0.6molNaOH |
| B、1molNa2CO3和1molNaOH |
| C、0.8molNa2CO3和1molNaOH |
| D、1molNa2CO3和0.6molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
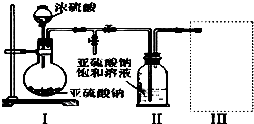
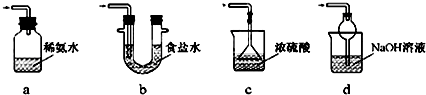
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、原子半径的大小为A>B>C>D |
| B、D的氢化物在同族元素的氢化物中沸点最低 |
| C、生成氢化物的稳定性为A>B>C>D |
| D、A、B、C、D的单质常温下均不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用试管取出试剂瓶中的NaOH溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
| B、银镜反应实验后的废液可先倒入水槽中,再用水冲入下水道 |
| C、向试管中滴加液体时,胶头滴管必须紧贴试管内壁,避免液体溅出 |
| D、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH为1的溶液:Ca2+、Na+、Mg2+、NO3- |
| B、滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、SCN- |
| C、与铝反应放出氢气的溶液:K+、HCO3-、Br-、Ba2+ |
| D、所含溶质为FeCl2的溶液:K+、SO42-、NO3-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com