
分析 (1)依据n=C×V,m=n×M计算,注意容量瓶的规格;
(2)依据配置物质的量浓度的一般顺序(计算、称量、溶解、冷却、转移、洗涤、定容、摇匀、装瓶)解答;
(3)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
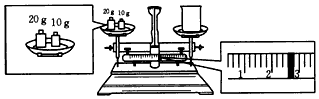
(4)天平称量的问题,先看图中称量方式是否是左物右码,如果不是,质量为砝码减游码,再据图读数;
(5)因为配置溶液过程需要颠倒摇匀,所以容量瓶在使用前必须检查是否漏水;
解答 解:(1)欲用NaOH 固体配制1.0mol/L的NaOH溶液240mL,应选择250mL容量瓶,需要的氢氧化钠的质量m=n×M=C×V×M=1.0mol/L×0.25L×40g/mol=10.0g;
故答案为:10.0;
(2)配制1.0mol/L的NaOH溶液的操作步骤为:计算、称量、溶解、冷却、转移、洗涤、摇动、定容、摇匀,所以正确操作顺序为:②①③⑧⑤⑥⑨⑦④;
故答案为:②①③⑧⑤⑥⑨⑦④;
(3)用托盘天平、钥匙、烧杯称量所需氢氧化钠的质量,在烧杯中溶解氢氧化钠固体,并用玻璃棒搅拌,加速溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入250ml的容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,
所有本实验必须用到的仪器除了天平、药匙、玻璃棒、烧杯还需要250 mL容量瓶、胶头滴管;
故答案为:250 mL容量瓶、胶头滴管;
(4)先看图中称量方式是左码右物,所称物品质量为砝码-游码,再据图读数,砝码20、10共30g,游码2.6g,所以烧杯质量为10+20-2.6=27.4g;
故答案为:27.4;
(5)因为配置溶液过程需要颠倒摇匀,所以容量瓶在使用前必须检查是否漏水;
故答案为:查漏.
点评 本题考查一定物质的量的溶液的配制实验,难度不大,明确配制原理及操作步骤是解题关键,选择仪器时注意考虑操作步骤,注意托盘天平的称量原理.


科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白色沉淀是BaSO4和BaSO3 | B. | FeCl3全部被还原为FeCl2 | ||
| C. | 白色沉淀是BaSO3 | D. | 溶液的酸性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 装置②的待镀铁制品应与电源正极相连 | |
| B. | 装置①中阴极上析出红色固体 | |
| C. | 装置③闭合开关后,外电路电子由a极流向b极 | |
| D. | 装置④的X电极是外接电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (物质序号)
(物质序号)查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中硫元素被氧化,所有铁元素均被还原 | |
| B. | 当转移1mol电子时,46 g CuFeS2参加反应 | |
| C. | 氧化产物是S,还原产物是Cu2+和Fe2+ | |
| D. | 还原剂是S2-,氧化剂是Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com