
 第VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种价态,含第VIA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
第VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种价态,含第VIA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:分析 (1)同周期元素自左而右,第一电离能呈增大趋势;氮原子2p能级有3个电子,处于半满稳定状态,其第一电离能大于O;
(2)CH3CH2OH含氢键,使其沸点升高;
(3)硒是34号元素,基态原子核外有34个电子,根据构造原理书写其核外电子排布式;根据分子空间构型确定其键角相对大小;
(4)二氧化硫分子中,中心原子S形成两个2个σ键和1对孤对电子,据此判断其中心原子的杂质方式及空间构型;
(5)①在晶胞结构中,黑颜色球代表的Cu位于体内,共4个;白颜色球代表的O有8个位于顶点、6个位于面心,利用均摊法计算出其化学式;
②根据晶胞结构可知,立方体体心的O原子周围含有4个铁离子,所以其配位数为4,晶体中距离最近的4个铜原子构成正四面体结构.
解答 解:(1)同周期元素自左而右,第一电离能呈增大趋势,但是氮原子2p能级有3个电子,处于半满稳定状态,电子能量降低,所以第一电离能高于同周期相邻元素的第一电离能,所以三者的第一电离能由小到大的顺序为:O<N<F,
故答案为:O<N<F;
(2)CH3CH2OH含氢键,使其沸点升高,CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是乙醇分子之间形成氢键,故答案为:乙醇分子之间形成氢键;
(3)硒是34号元素,基态原子核外有34个电子,其基态原子核外电子排布式为:1s22s22p63s23p63d104s24p4;CSe2与CO2结构相似,二氧化碳是直线型分子,H2Se分子为v型分子,所以CSe2分子内的Se-C-Se键角大于H2Se分子内的H-Se-H键角,
故答案为:1s22s22p63s23p63d104s24p4;大于;
(4)二氧化硫分子中,中心原子S形成两个2个σ键、含有1对孤对电子,故杂化轨道数为3,采取sp2杂化,其空间结构为V形,
故答案为:V形;sp2;
(5)①在晶胞结构中,黑颜色球代表的Cu位于体内,共4个;白颜色球代表的O有8个位于顶点、6个位于面心,晶胞中总个数为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,化学式可写为CuO,
故答案为:CuO;
②氧化铜晶胞的体心的氧离子周围包围了4个铜离子,则其配位数为4;由于晶体中距离最近的4个铜原子与体心的氧原子距离完全相同,所以这四个Cu原子构成了正四面体结构,
故答案为:4;正四面体.
点评 本题考查了晶胞的计算、配合物的成键情况的判断、元素周期律的应用等知识,题目难度较大,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力,注意掌握均摊法在计算晶胞化学式中的应用,明确配合物的成键情况.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2O是白色固体,和冷水作用得到O2和NaOH | |
| B. | Na2O2与水的反应中,Na2O2既是氧化剂,又是还原剂 | |
| C. | Na2O2中氧的化合价是-1价 | |
| D. | 都能与酸反应,生成盐和水,都是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 绿矾 | 醋精 | 苏打 | 酒精 | 铜导线 | 蔗糖 | 烧碱 |
| 主要 成分 | FeSO4 | CH3COOH | Na2CO3 | CH3CH2OH | Cu | C12H22O11 | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C和14C属于同一种元素,它们互为同位素 | |
| B. | 6Li和7Li的电子数相等,中子数也相等 | |
| C. | 14C和14N的质量数相等,它们的中子数不等 | |
| D. | 1H和2H是不同的核素,它们的质子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲和乙分别是C和Mg | |
| B. | 乙元素形成的某种单质可能是天然物质中硬度最大的 | |
| C. | 甲与乙处于同一主族 | |
| D. | 乙元素的单质与冷水反应很快而遇热水则发生爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
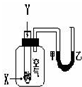 某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到U型管中液面甲处降、乙处升.关于该反应的下列叙述:其中正确的是( )
某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到U型管中液面甲处降、乙处升.关于该反应的下列叙述:其中正确的是( )| A. | ①③ | B. | ①④⑤ | C. | ②③⑤ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com