
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,图为两套实验装置。
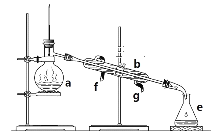
(1)写出下列仪器的名称:
a.__________________
b.__________________
(2)若利用装置I分离四氯化碳和酒精的混合物还缺少的仪器是__________,将仪器补充完整后进行实验。冷凝水由________(填f或g)口通入。
科目:高中化学 来源: 题型:
【题目】对氨基苯甲酸可用甲苯为原料合成,已知苯环上的硝基可被还原为氨基:![]() +3Fe+6HCl→
+3Fe+6HCl→![]() +3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )
+3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )
A.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
B.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
C.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
D.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下:
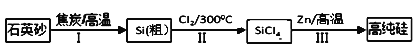
(1)1mol焦炭在过程Ⅰ中失去____mol电子。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为________。
(3)步骤(2)中的电解过程中,若用甲醇燃料电池作电源,用KOH作电解质,负极反应为_________。
(4)整过生产过程必须严格控制无水,回答下列问题:
①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为_________。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是_________。
(5)Zn还原SiCl4的可逆反应如下:
SiCl4(g)+2Zn(s)![]() Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
A.还原过程需在无氧的气氛中进行 |
B.投入1molZn可生成14g还原产物 |
C.增加SiCl4(g)的量,该反应平衡常数不变 |
D.若SiCl4(g)过量可增大△H的值 |
(6)有一种由硅制作的材料中常加入Ag2SO4 ,已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ag2SO4的Ksp=_______(两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图(A)处通入Cl2,当关闭(B)阀时,(C)处的湿润的红布条没有明显变化,当打开(B)阀时,(C)处的湿润红布条逐渐褪色,则(D)瓶中装的溶液是( )

A.浓硫酸B.NaOH溶液C.水D.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后产生1.16g白色沉淀,在所得的浊液中逐滴加入1 molL-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示。
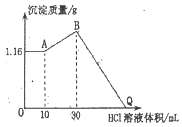
请回答下列问题:
(1)B点的沉淀物的化学式为_____
(2)写出混合物溶于水时发生反应的离子方程式_____
(3)原混合物中MgCl2的物质的量为_____
(4)原固体混合物中NaOH的质量为_____
(5)Q点加入HCl溶液的体积为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需配制0.1mol/LNaOH溶液450mL,如图是某同学转移溶液的示意图。
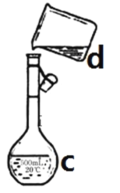
(1)写出下列仪器的名称:c.__________________
(2)图中的错误是____________________________。
(3)根据计算得知,所需NaOH的质量为____________g
(4)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)_______________。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH=4的硫酸溶液分别稀释成原体积的10倍、100倍、10000倍。则稀释后溶液的pH分别为( )
A.5、6、8B.5、6、7C.4.7、6.7、8D.4.7、6.7、7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用脱硫后的天然气合成氨的某流程如下:
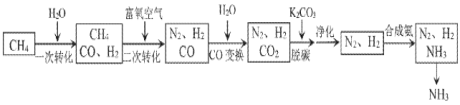
(1)“一次转化”中H2O(g)过量的目的是______。
(2)已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(g)△H=-484kJmol-1
2CO(g)+O2(g)=2CO2(g)△H=-566kJmol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802kJmol-1
“二次转化”时CH4和O2反应生成CO和H2的热化学方程式为______。
(3)“CO变换”的反应是CO(g)+H2O(g)CO2(g)+H2(g)某温度下,该反应的平衡常数K=1,若要使CO的转化率达到90%,则起始时c(H2O):c(CO)应不低于______。
(4)“脱碳”后的溶液再生的方法是______(以化学方程式表示)。
(5)“净化”时发生的反应为 [Cu(NH3)2]Ac(aq)+CO(g)+NH3(g)[Cu(NH3)3CO]Ac(aq),△H<0。充分吸收CO采取的措施是______(选填序号)。
a 升温b 降温c 加压d 减压
(6)已知N2(g)+3H2(g)2NH3(g)△H<0,平衡时NH3的物质的量分数c(NH3)与氢氮比x(H2与N2的物质的量比)的关系如图:
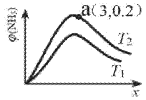
①T1______T2(填“>”、“=”或“<”)。
②a点总压为50Mpa,T2时Kp=______(Mpa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
③实验测得一定条件下合成氨反应的速率方程为v=kc(N2)c1.5(H2)c-1(NH3)。以下措施既能加快反应速率,又能提高H2平衡转化率的是______
a 加压b 使用催化剂c 增大氢氮比d 分离NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁(Ⅲ)酸钾制备流程如图所示,下列有关说法不正确的是( )
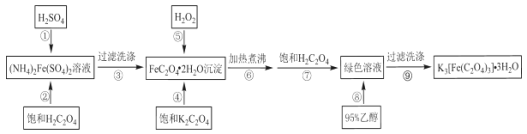
A.在步骤①中加入少量硫酸的目的是防止硫酸亚铁铵的水解,提高草酸亚铁的纯度
B.FeC2O42H2O转化为绿色溶液的离子方程式为:2FeC2O42H2O+H2O2+3C2O42-+H2C2O4=2[Fe(C2O4)3]3-+3H2O
C.在步骤⑥中加热煮沸的目的是为了加快H2O2将亚铁充分氧化为三价铁
D.步骤③与⑨洗涤沉淀的洗涤剂分别可为蒸馏水、无水乙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com