
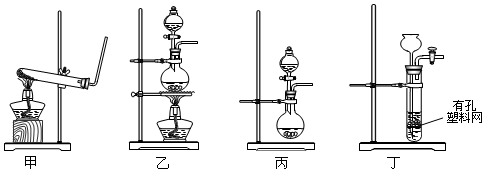
分析 (1)制备氨气为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,制取NO2可选硝酸钠、亚硝酸钠溶液制备,制取Cl2选浓盐酸与二氧化锰反应制备;
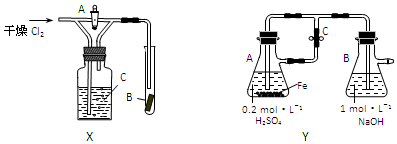
(2)验证Cl2能使有色布条褪色的真正原因.利用对比实验说明,开始实验时,首先应打开活塞,后关闭活塞,对比现象;
(3)制取Fe(OH)2时,为了防止Fe(OH)2被O2氧化,通常采用Y装置,先打开C,利用生成的氢气将装置内空气排出,再关闭C,利用氢气的压强将硫酸亚铁排入B中;
(4)I.配制前后溶质的物质的量不变;
II.浓溶液配制溶液时,计算、量取、稀释、冷却、转移、洗涤、定容、摇匀、装瓶;
Ⅲ.如果定容时俯视刻度线,V偏小,结合c=$\frac{n}{V}$分析.
解答 解:(1)制备氨气为固体与固体加热原理,选择甲装置,反应为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,制取NO2可选硝酸钠、亚硝酸钠溶液制备,为液体混合,可选丙装置;制取Cl2选浓盐酸与二氧化锰反应制备,为固体与液体反应加热原理,选择乙装置,
故答案为:甲;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;丙;乙;
(2)验证Cl2能使有色布条褪色的真正原因.利用对比实验说明,开始实验时,首先应打开活塞,后关闭活塞,对比可知干燥的氯气不能有色布条褪色,
故答案为:打开;
(3)制取Fe(OH)2时,为了防止Fe(OH)2被O2氧化,通常采用Y装置,先打开C,利用生成的氢气将装置内空气排出,再关闭C,利用氢气的压强将硫酸亚铁排入B中,可发生硫酸亚铁与NaOH的反应生成氢氧化亚铁,观察到白色沉淀生成,
故答案为:打开;利用氢气的压强将硫酸亚铁排入B中;
(4)I.用18mol•L-1的浓硫酸,配制100mL 2mol•L-1的硫酸溶液,由配制前后溶质的物质的量不变,可知浓硫酸的体积为$\frac{0.1L×2mol/L}{18mol/L}$=0.0111L=11.1mL,
故答案为:11.1;
II.浓溶液配制溶液时,计算、量取、稀释、冷却、转移、洗涤、定容、摇匀、装瓶,且定容时加水至刻度线2cm~3cm,改用胶头滴管滴加,则正确的步骤为①③④②⑤,
故答案为:①③④②⑤;
Ⅲ.如果定容时俯视刻度线,V偏小,由c=$\frac{n}{V}$可知,配制溶液的浓度偏低,故答案为:偏低.
点评 本题考查物质的制备实验,为高频考点,把握制备原理、实验装置的作用、溶液的配制、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | NaNO2是还原剂 | B. | 生成1个N2时转移的电子数为6个 | ||
| C. | NH4Cl中的N元素被还原 | D. | N2既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2(PO4)3(OH) | B. | Ca5(PO4)3(OH) | C. | Ca4(PO4)3(OH) | D. | Ca3(PO4)3(OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②④ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度的 CH3COOH 与 KOH 任意比混合:c(K+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 在滴有酚酞溶液的氨水里,加入盐酸至恰好呈无色,则此时溶液的 pH=7 | |
| C. | 浓度均为 0.1 mol/L 的氨水和氯化铵溶液,水电离出的 c(H+)前者大于后者 | |
| D. | 常温下 pH 为 5 的盐酸溶液稀释 1000 倍后,pH 等于 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果a1=a2,b1=b2,则混合溶液中c(CH3COO-)=c(Na+) | |
| B. | 如果混合溶液的PH=7,则混合溶液中c(CH3COO-)>c(Na+) | |
| C. | 如果混合溶液的PH<7,则a1b1=a2b2 | |
| D. | 如果a1=a2,且混合溶液的PH<7,则b1>b2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 城市 | 污染指数 | 首要污染物 | 空气质量等级 | ||
| SO2 | NO2 | PM10 | |||
| A | 98 | 23 | 67 | SO2 | Ⅱ |
| B | 47 | 29 | 35 | SO2 | Ⅰ |
| C | 62 | 80 | 113 | PM10 | Ⅲ |
| D | 52 | 76 | 59 | NO2 | Ⅰ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com